
| A、2v正(X)=v逆(Y) |
| B、单位时间内生成1 mol Y的同时生成2 mol X |
| C、混合气体的密度不再变化 |
| D、反应容器中Y的质量分数不变 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
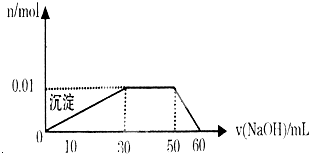
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| ③ | 加足量BaCl2溶液时,所得沉淀为6.27g,向沉淀中加足量稀盐酸,然后干燥、称量为2.33g. | |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
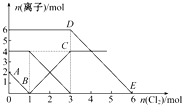 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,则下列有关说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、线段AB表示Fe2+被氯气氧化 |
| C、线段BC表示生成4 mol Fe3+ |
| D、原溶液中n(Br-)=6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com