
分析 氯代烷(RCl)与足量的氢氧化钠溶液混合后加热,发生反应RCl+NaOH→ROH+NaCl,向酸化后的溶液中加AgNO3溶液时,发生反应NaCl+AgNO3=AgCl↓+NaNO3,根据消耗的AgNO3计算一氯代烷(RCl)的物质的量,再根据M=$\frac{m}{n}$计算一氯代烷(RCl)的摩尔质量,据此确定烷基,确定一氯代烷(RCl)的分子式,结合题目要求可确定有机物结构简式.
解答 解:(1)一氯代烷(RCl)与足量的氢氧化钠溶液混合后加热,发生反应RCl+NaOH→ROH+NaCl,向酸化后的溶液中加AgNO3溶液时,发生反应NaCl+AgNO3=AgCl↓+NaNO3,消耗AgNO3的物质的量=0.02L×1mol/L=0.02mol,根据方程式可知n(RCl)=n(AgNO3)=0.02mol,故一氯代烷(RCl)的摩尔质量=$\frac{1.85g}{0.02mol}$=92.5,故烷基的式量为92.5-35.5=57,令烷基为CnH2n+1,则14n+1=57,解得n=4,故该一氯代烷的分子式为C4H9Cl,
故答案为:C4H9Cl;
(2)C4H9Cl的同分异构体有:CH3CH2CH2CH2Cl、CH3CH2CHClCH3、CH3CH(CH3)CH2Cl、(CH3)3CCl,其中CH3CH2CH2CH2Cl、CH3CH2CHClCH3核磁共振氢谱有4组峰,且水解产物经催化氧化生成醛类只有CH3CH2CH2CH2Cl,
故答案为:CH3CH2CH2CH2Cl.
点评 本题考查有机物分子式的确定、同分异构体书写,侧重于学生的分析、计算能力的考查,难度中等,清楚发生的反应计算一氯代烷的物质的量是解题关键,注意把握有机物同分异构体的判断.


科目:高中化学 来源: 题型:选择题
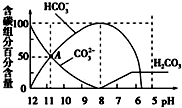
| A. | 0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当加入20 mL盐酸时,混合溶液的pH约为8 | |
| C. | 常温下CO2饱和溶液的pH约为5.6 | |
| D. | 在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示 | |
| B. | 平衡常数越大,表示化学反应速率越大 | |
| C. | 可以用化学平衡常数来定量描述化学反应的限度 | |
| D. | 平衡常数的大小与温度、浓度、压强、催化剂有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 石蕊 | 酚酞 | 石蕊 |
| 小烧杯中的溶液 | 浓盐酸 | 浓氨水 | NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
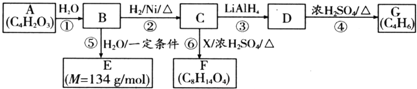
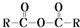 $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH 、
、 .
.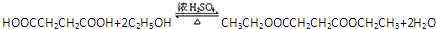 .
.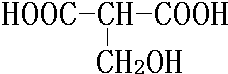 、
、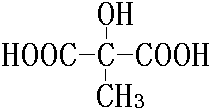 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | |
| SiCl4 | -70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
| Si3N4 | 1900 | - | 性质稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、CO32- | ||
| C. | NH4+、Na+、Cl-、SO42- | D. | NH4+、K+、SiO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com