
分析 (1)①根据该金属常用于制造门窗框架,其合金具有密度小、强度高的优良性能,可知为铝;
②聚乙烯是由乙烯通过加成聚合生成的高分子材料;
③天然橡胶通过硫化措施可增大强度和弹性;
(2)①可导致光化学烟雾的气体主要是氮氧化物;
②随意的堆放生活垃圾,会污染环境;
③明矾中的铝离子水解生成氢氧化铝胶体;
④氯气在NaOH溶液中自身发生氧化还原反应生成NaCl和NaClO;
(3)①阿司匹林属于解热镇痛的药物;
②青霉素的作用是消炎;
③淀粉水解的最终产物是葡萄糖;
④碳酸镁可与胃酸中的盐酸反应.
解答 解:(1)①铝合金:铝中加入镁、铜、锌等金属形成合金,具有密度小、强度高的优良性能常用于制造门窗框架,故答案为:a;
②聚乙烯是由乙烯通过加成聚合生成的高分子材料,故选:b;
③天然橡胶通过硫化措施可增大强度和弹性,使橡胶既有弹性又不易变形,故答案为:硫化;
(2)①可导致光化学烟雾的气体主要是氮氧化物,故答案为:c;
②a.用中和法除去工业废水中的酸,可防止酸中毒;b.在燃煤中添加石灰石粉末,可除去二氧化硫;c.随意的堆放生活垃圾,会污染环境,故答案为:c;
③明矾中的铝离子水解生成氢氧化铝胶体,具有吸附性能净水,故答案为:b;
④氯气在NaOH溶液中自身发生氧化还原反应生成NaCl和NaClO,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)①阿司匹林属于解热镇痛的药物,故答案为:c;
②青霉素的作用是消炎,属于抗生素,故答案为:b;
③淀粉为多糖,水解的最终产物是葡萄糖,化学式:C6H12O6,故答案为:C6H12O6;
④碳酸镁可与胃酸中的盐酸反应,反应方程式:MgCO3+2H+═Mg2++H2O+CO2↑,故答案为:MgCO3+2H+═Mg2++H2O+CO2↑.
点评 本题考查化学与生活,考查内容较多,侧重于基础知识的考查,题目难度不大,注意相关基础知识的积累,


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
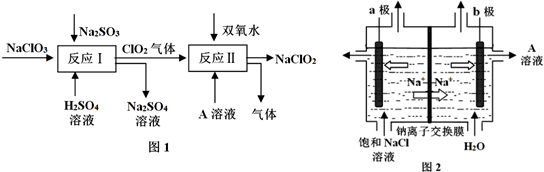
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
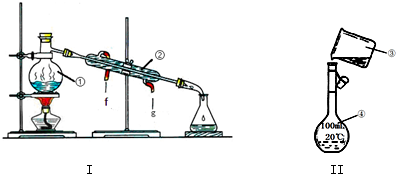
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H10 | B. | C10H16 | C. | C12H22 | D. | C14H22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
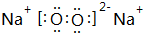 ,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
,写出M2Z2与水反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )| A. | $\frac{n}{10}$ mol | B. | $\frac{n}{11}$ mol | C. | $\frac{n}{12}$ mol | D. | $\frac{n}{13}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,将相同的铝片分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加Na2S溶液可以得到Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E的氢化物的电子式
E的氢化物的电子式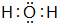 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com