
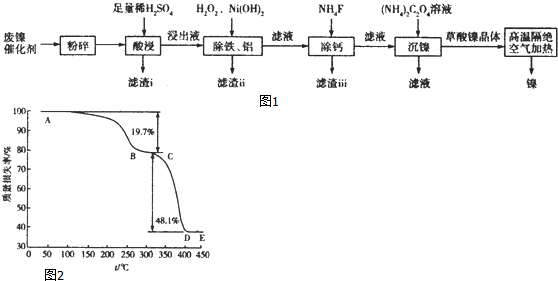
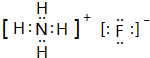
���� �����������飬����������ĽӴ������SiO2�������ᷴӦ������iΪ�������裬���˵õ���Һ�к���NiSO4��FeSO4��Al2��SO4��3��CaSO4�����������ᣬ���� ����H2O2��Fe2+����ΪFe3+������Ni��HO��2����5.0��pH��6.7��ʹFe3+ת��ΪFe��OH��3������Al3+ת��ΪAl��OH��3���������˳�ȥ����Һ�к���NiSO4��CaSO4������Һ�м���NH4F����ȥCa 2+�����ˣ�������Һ�м��루NH4��2C2O4���õ��������������ٹ��ˡ�ϴ�ӡ�����ò��������壬����ֽ�õ�Ni��
��1����������Ũ�ȡ������¶�Ҳ��������������ʣ�������i���ijɷ�Ϊ�������裻
��2������Ni��HO��2������ҺpH��ʹFe3+ת��ΪFe��OH��3������Al3+ת��ΪAl��OH��3���������˳�ȥ��
��3��������ii���к����������������������������������ܽ⣬���˵õ�������������Һ��ͨ�������̼�õ�����������
��4����������NH4F��Һ������CaF2������NH4F��笠�����������ӹ��ɣ�
��5������Ksp��NiC2O4��=c��C2O42-����c�� Ni2+���T4.05��10-10���㣻
��6����һ����Ϊʧȥ�ᾧˮ������������ʧ�ʼ���n��ֵ���ڶ�����ΪNiC2O4�ֽ�����Ni����C��Oԭ��֮�ȿ�֪ͬʱ���ɶ�����̼��
��� �⣺�����������飬����������ĽӴ������SiO2�������ᷴӦ������iΪ�������裬���˵õ���Һ�к���NiSO4��FeSO4��Al2��SO4��3��CaSO4�����������ᣬ���� ����H2O2��Fe2+����ΪFe3+������Ni��HO��2����5.0��pH��6.7��ʹFe3+ת��ΪFe��OH��3������Al3+ת��ΪAl��OH��3���������˳�ȥ����Һ�к���NiSO4��CaSO4������Һ�м���NH4F����ȥCa 2+�����ˣ�������Һ�м��루NH4��2C2O4���õ��������������ٹ��ˡ�ϴ�ӡ�����ò��������壬����ֽ�õ�Ni��
��1���ʵ���������Ũ�ȡ������¶�Ҳ��������������ʣ��������費���ᷴӦ��������i���ijɷ�Ϊ�������裬
�ʴ�Ϊ���ʵ���������Ũ�ȡ������¶ȣ��������裻
��2������Ni��HO��2������ҺpH��ʹFe3+ת��ΪFe��OH��3������Al3+ת��ΪAl��OH��3���������˳�ȥ��
�ʴ�Ϊ��������ҺpH��ʹFe3+��Al3+ת��Ϊ������
��3��������ii���к��������������������������뷽��Ϊ���������������������Һ�����˵õ���������������Һ��ͨ������Ķ�����̼�����˵õ�����������
�ʴ�Ϊ���������������������Һ�����˵õ���������������Һ��ͨ������Ķ�����̼�����˵õ�����������
��4����������NH4F��Һ������CaF2��������Ӧ���ӷ���ʽΪ��2F-+Ca2+=CaF2����NH4F��笠�����������ӹ��ɣ�����ʽΪ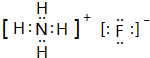 ��
��
�ʴ�Ϊ��2F-+Ca2+=CaF2����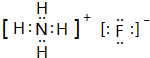 ��
��
��5��C2O42-��Ũ��Ϊ0.0900mol•L-1������Ksp��NiC2O4��=c��C2O42-����c�� Ni2+��=4.05��10-10����֪c�� Ni2+��=4.5��10-9mol/L��
�ʴ�Ϊ��4.5��10-9mol/L��
��6����һ����Ϊʧȥ�ᾧˮ����$\frac{18n}{59+24+64+18n}$=19.7%�����n=2��
�ڶ�����ΪNiC2O4�ֽ�����Ni����C��Oԭ��֮�ȿ�֪ͬʱ���ɶ�����̼����Ӧ����ʽΪ��NiC2O4$\frac{\underline{\;\;��\;\;}}{\;}$Ni+2CO2����
�ʴ�Ϊ��2��NiC2O4$\frac{\underline{\;\;��\;\;}}{\;}$Ni+2CO2����
���� ���⿼�������Ʊ��������̣��漰���ʷ����ᴿ���������ơ��ܶȻ��йؼ���ȣ��ؼ��ǶԹ������̵����⣬ע�������ҺpH��ȥ�������ӣ�����ԭ���������µ����ʣ���Ŀ�Ѷ��еȣ�


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ӳ�����X��Y��Z | B�� | ��̬�⻯���ȶ��ԣ�XH3��YH3��ZH3 | ||
| C�� | ԭ��������X��Y��Z | D�� | Ԫ�صķǽ�����ǿ����X��Y��Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH${\;}_{4}^{+}$��NH3 | B�� | S��S2- | C�� | HCl��Cl2 | D�� | CO32-��CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
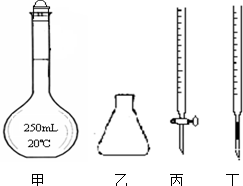 ���������һ����Ҫ�Ļ�ѧ�Լ�������Һ���Ǻ��ȶ��������������»�ֽ����ɶ������̺������������Ի���������Һ�зֽ��ٶȺ���������ֽ��ٶȼӿ죮
���������һ����Ҫ�Ļ�ѧ�Լ�������Һ���Ǻ��ȶ��������������»�ֽ����ɶ������̺������������Ի���������Һ�зֽ��ٶȺ���������ֽ��ٶȼӿ죮| ������������Һ�Ĵ���ÿ����Һ�������ͬ�� | ���������Һ��ɫ��ȥ��ʱ�� |
| �ȵ����1�� | 1min |
| ��ɫ���ٵ����2�� | 15s |
| ��ɫ���ٵ����3�� | 3s |
| ��ɫ���ٵ����4�� | 1s |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Q1+Q2=92.4 | |
| B�� | ��ƽ��ʱ�ס�����NH3����������ң��� | |
| C�� | �ﵽƽ����������м���0.25mol N2��g����0.75mol H2��g����1.5mol NH3��g����ƽ��������N2�ķ����ƶ� | |
| D�� | ��ƽ��ʱ����N2��ת����Ϊ25% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
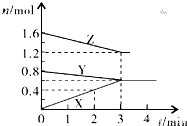 ij�¶�ʱ����2L�ܱ������У�X��Y��Z�������ʵ����ʵ������仯��������ͼ��ʾ����ͼ�����ݷ���
ij�¶�ʱ����2L�ܱ������У�X��Y��Z�������ʵ����ʵ������仯��������ͼ��ʾ����ͼ�����ݷ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
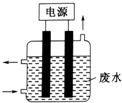 ��8•12������Σ���ֿⱬը������������Ʋ����ش���ʧ���ݲ�Σ���ֿ��д��д������ơ��أ�����狀��軯�ƣ�NaCN������ش��������⣺
��8•12������Σ���ֿⱬը������������Ʋ����ش���ʧ���ݲ�Σ���ֿ��д��д������ơ��أ�����狀��軯�ƣ�NaCN������ش��������⣺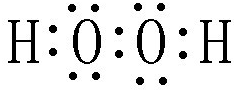 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
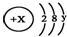 ��X��Y ��Ϊ������20�����������ݴ˻ش��������⣺
��X��Y ��Ϊ������20�����������ݴ˻ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com