
| A、135 |
| B、64g?mol-1 |
| C、64 |
| D、135g?mol-1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2d | B、2.5d |
| C、5d | D、10d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn2+>Cu2+>Ag+ |
| B、Zn2+>Ag+>Cu2+ |
| C、Cu2+>Ag+>Zn2+ |
| D、Ag+>Cu2+>Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2分子和32 g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 C CO2 CO NaHCO3 |
| B、Na2S S SO2 Na2SO3 Na2SO4 |
| C、NH4Cl N2 NaNO2 NO2 HNO3 |
| D、P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝的熔点很高,所以不可以用来冶炼铝 |
| B、氢氧化铝可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,所以明矾可用作净水剂 |
| C、实验室可以用过量氢氧化钠与氯化铝来制备氢氧化铝 |
| D、氢氧化铝既可与酸反应又可与碱反应,是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
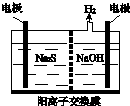 Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.
Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com