
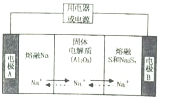
 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用| 物质 | Na | s | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
| 19.2g |
| 64g/mol |


科目:高中化学 来源: 题型:
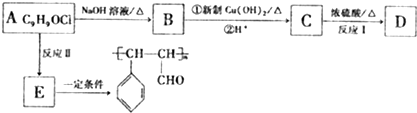
 结构的芳香族化介物的同分异构体有
结构的芳香族化介物的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①② | B、①④ | C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
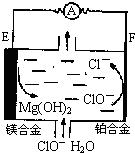 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| CuO |
| CeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 K,Fe,C,N,O,S是中学化学常见的六种元素.
K,Fe,C,N,O,S是中学化学常见的六种元素.| 第一电离能 | 键的极性 | 熔点 | 稳定性 |
| N | H-S键 | 金刚石 | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com