
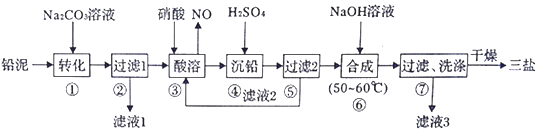
分析 以100.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐:向铅泥中加Na2CO3溶液是将PbSO4转化成PbCO3,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,Pb、PbO和PbCO3在硝酸的作用下反应:3Pb+8HNO3=Pb(NO3)2+2NO↑+4H2O、PbCO3+2HNO3=Pb(NO3)2+CO2↑+H2O、PbO+2HNO3=Pb(NO3)2+2H2O,均转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,过滤的滤液为HNO3,可循环利用,向硫酸铅中加入氢氧化钠合成三盐和硫酸钠,4PbSO4+6NaOH$\frac{\underline{\;50~60℃\;}}{\;}$3PbO•PbSO4•H2O+3Na2SO4+2H2O,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,据此分析解答.
解答 解:(1)步骤①向铅泥中加Na2CO3溶液,由表可知PbCO3的溶解度小于PbSO4的溶解度,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),则可将PbSO4转化成PbCO3,所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3;
故答案为:将PbSO4转化为PbCO3,提高铅的利用率;Na2SO4;
(2)酸溶时,为提高酸溶速率,可采取的措施是适当升温(或适当增大硝酸浓度或减小沉淀粒径等);铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为:3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;
故答案为:适当升温(或适当增大硝酸浓度或减小沉淀粒径等);3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O;
(3)Pb、PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,HNO3可循环利用,若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,已知Ksp(PbSO4)=1.82×10-8,则此时c(SO42-)=$\frac{1.82×1{0}^{-8}}{1.82×1{0}^{-5}}$mol/L=1.00×10-3mol/L;
故答案为:HNO3;1.00×10-3;
(4)步骤⑥合成三盐的化学方程式为:4PbSO4+6NaOH$\frac{\underline{\;50~60℃\;}}{\;}$3PbO•PbSO4•H2O+3Na2SO4+2H2O,若得到纯净干燥的三盐49.5t,则其中铅元素的质量为:$\frac{828}{990}$×49.5t=41.4t,设铅泥中铅元素的质量分数为w,则100.0t铅泥中铅元素为100×w,铅泥中的铅元素有80%转化为三盐,有100×w×80%=41.4,解得x=51.75%;步骤⑦沉淀表面附着硫酸根离子,检验沉淀是否洗净,检测其洗涤液是否含有硫酸根离子即可,方法为:取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全;
故答案为:4PbSO4+6NaOH$\frac{\underline{\;50~60℃\;}}{\;}$3PbO•PbSO4•H2O+3Na2SO4+2H2O;51.75%;取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉水解后的溶液中加入碘水,溶液变蓝色,证明淀粉没有水解 | |
| B. | 向NaOH溶液中滴加浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液,出现红褐色沉淀,由此可知Ksp[Fe(OH)3]<Ksp[Al(OH)3] | |
| C. | 向待测试样中加入过量稀盐酸无现象,再滴加BaCl2溶液,有白色沉淀生成,证明试样中含SO42- | |
| D. | 将Fe(NO3)2样品溶于稀硫酸,再滴加KSCN溶液变为红色,证明样品已部分或全部变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=2.0mol•L-1•min-1 | B. | v(B)=4.0mol•L-1•min-1 | ||
| C. | v(C)=0.1mol•L-1•s-1 | D. | v(D)=0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 庚烷分子中含共价键 23 NA | |
| B. | 所有烷烃分子中均存在极性键和非极性键 | |
| C. | C2H4、C2H4Br2、CH2Cl2均只能代表一种物质 | |
| D. | A、B 两种烃,它们含碳质量分数相同,则 A 和 B 最简式一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素不互为同分异构体,但二者完全水解的产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 对苯二甲酸(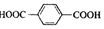 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚醋纤维( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚醋纤维(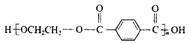 ) ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com