
 Mg(OH)2↓+CO2↑+H2O
Mg(OH)2↓+CO2↑+H2O mol×74 g·mol-1=66.6 g
mol×74 g·mol-1=66.6 g

 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“水发电技术”是指水分解生成氢气和氧气,同时放出能量来发电 |
| B.“水发电技术”的能量转换形式为:化学能→热能→电能 |
| C.若水分解产生的H2和O2分别通入燃料电池的两极,通H2的极为电源正极 |
| D.“水发电技术”可实现发电过程中的零排放 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
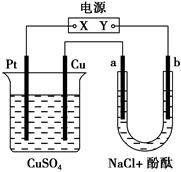
| A.X是正极,Y是负极 |
| B.X是负极,Y是正极 |
| C.CuSO4溶液的pH逐渐变小 |
| D.CuSO4溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子交换法 | B.中和法 | C.反渗透法 | D.蒸馏法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
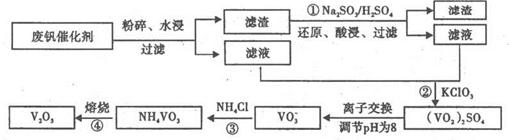

 VO2++V3++H2O
VO2++V3++H2O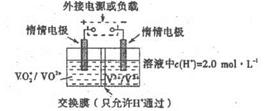
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度太低反应速率太小 |
| B.该温度时催化剂活性较高 |
| C.该温度时反应速率最大 |
| D.该温度时N2的转化率最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com