
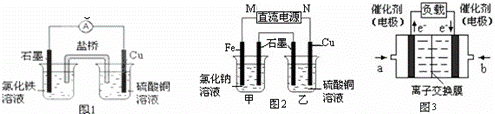
(1)图1装置发生反应的离子方程式为 .
(2)图2装置中甲烧杯盛放100mL 0.2mol•L﹣1的NaCl溶液,乙烧杯盛放100mL 0.5mol•L﹣1L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红.
①电源的M端为 极,甲烧杯中铁电极的电极反应为 .
②乙烧杯中电解反应的化学方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64g,甲烧杯中产生的气体标准状况下体积为 mL.
(3)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 b处的电极反应式 ﹣ ,
甲醇燃料电池的总反应化学方程式 .
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | (1)图1装置发生反应为铜和铁离子的氧化还原反应; (2)向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH﹣,应为电解池的阴极,则M为正极,N为负极,乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,结合电极方程式解答该题; (3)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,a处通入的是氢气、b处通入的是氧气,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水生成氢氧根离子,据此书写电池反应式. |
| 解答: | 解:(1)铜可被Fe3++氧化,发生Cu+2Fe3+=Cu2++2Fe2+,形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,正极反应为Fe3++e﹣=Fe2+, 故答案为:Cu+2Fe3+=Cu2++2Fe2+; (2)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜, ①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH﹣,应为电解池的阴极,则M为正极,N为负极,电解氯化钠溶液,阳极发生氧化反应生成亚铁离子,电极方程式为Fe﹣2e﹣═Fe2+, 故答案为:正;Fe﹣2e﹣═Fe2+; ②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O 故答案为:2Cu2++2H2O ③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为 甲烧杯中,阳极铁被氧化,阴极产生气体为氢气, 2H2O+2e﹣═2OH﹣+H2↑, 2mol 22.4L 0.02mol V V= 故答案为:224; (3)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,a处通入的是氢气、b处通入的是氧气,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水生成氢氧根离子,电极反应式为O2+4e﹣+2H2O=4OH﹣,电池反应式为2CH3OH+4KOH+3O2=2K2CO3+6H2,故答案为:O2+4e﹣+2H2O=4OH﹣;2CH3OH+4KOH+3O2=2K2CO3+6H2. |
| 点评: | 本题考查了原电池和电解池原理,根据各个电极上发生的反应再结合转移电子相等来分析解答,难点是(3)中负极电极反应式的书写,要结合电解质溶液酸碱性酸性,题目难度不大. |


科目:高中化学 来源: 题型:
有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为: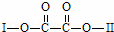 (其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如下的转化示意图:
(其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如下的转化示意图:
已知向D的水溶液中滴入FeCl3溶液发生显色反应,滴入NaHCO3溶液有无色无味气体产生,且D苯环上的一氯代物有两种.
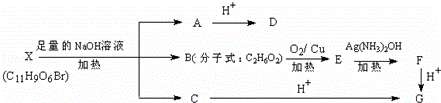
(1)D中含氧官能团的名称: ;X的结构简式为: ;
(2)写出B→E的化学方程式:
(3)D可能发生的反应有:
A.加成反应 B.消去反应 C.取代反应 D.氧化反应 E.加聚反应
(4)D有多种同分异构体,分别写出满足下列三个条件的同分异构体各一种:①遇FeCl3溶液发生显色反应,②能发生银镜反应,③能发生水解反应的同分异构体的结构简式为: ,①遇FeCl3溶液发生显色反应,②能发生银镜反应,③不能发生水解反应的同分异构体的结构简式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于A2(g)+3B2(g)⇌2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是( )
|
| A. | v(A2)=0.008 mol•L﹣1•s﹣1 | B. | v(A2)=0.3 mol•L﹣1•min﹣1 |
|
| C. | v(AB3)=0.01 mol•L﹣1•s﹣1 | D. | v(B2)=0.012 mol•L﹣1•s﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间后,下列有关描述正确的是( )
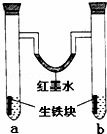
|
| A. | 红墨水柱两边的液面变化是左高右低 |
|
| B. | b试管中溶液pH值减小 |
|
| C. | 两试管中相同的电极反应式是:Fe﹣3e﹣=Fe3+ |
|
| D. | a试管中阳极反应式为:O2+2H2O﹣4e﹣=4OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为PbO2+Pb+
4H++2S ====2PbSO4+2H2O。下列有关说法正确的是 ( )
====2PbSO4+2H2O。下列有关说法正确的是 ( )

A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向负极区迁移
C.K与M相接时,所用电源的a极为负极
D.K与M相接时,阳极附近的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
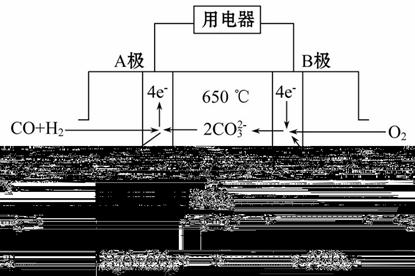
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应。
(2)电池总反应式为__________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标准状况),则阴极产物的质量为_________g。电解后溶液体积为1 L,溶液的pH约为________。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是_______________________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铝、硫酸钾和明矾[KAl(SO4)2•12H2O]的混合溶液中,SO42﹣的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
|
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
 +H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL
0.01 mol·L-1 H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com