
【题目】按要求书写方程式
(1)高温下铝与氧化铁反应的化学方程式 。
(2)惰性电极电解AgNO3溶液的离子方程式 。
(3)工业制硝酸吸收塔中发生反应的离子方程式 。
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、可持续发展密切相关,下列说法不正确的是
A.空气中PM2.5(2.5微米以下的颗粒物)的存在一定能够形成丁达尔效应
B.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
C.聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物材料
D.水体的富营养化与含N、P洗衣粉广泛使用有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。

⑴取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。

②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原_____________________________。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ:______________________________;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:_____________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中_____________,实验b中_________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 强电解质一定是离子化合物 B. 强电解质、弱电解质的电离都是吸热过程
C. 强电解质的饱和溶液一定是浓溶液 D. 强电解质在水中一定能全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池充放电的总反应为:![]() ,下列关于铅蓄电池的说法正确的是( )
,下列关于铅蓄电池的说法正确的是( )
A. 在放电时,两极质量均增加
B. 在充电时,电池中硫酸的浓度不断变小
C. 在放电时,负极发生的反应是 Pb + 2e- + SO42-=PbSO4
D. 在放电时,正极发生的反应是 PbSO4 + 2e- =Pb + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学生利用下图装置测定反应过程中所放出的热量并计算中和热。所用药品为50ml 0.50mol·L-1盐酸与50ml 0.55mol·L-1NaOH溶液。请回答下列问题:
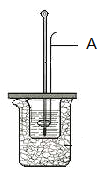
(1)图中A仪器名称为__________。其作用为__________。
(2)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是____________。
A.测量盐酸的温度后,温度计没有用水冲洗干净,立即去测量氢氧化钠溶液的温度
B.把量筒中的氢氧化钠溶液一次性快速倒入小烧杯
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
II.(1)原电池是将化学能转化为电能的装置,现将下列化学反应设计成带盐桥原电池,请你画出该原电池装置简图(标明电极材料名称和试剂名称):Zn+CuSO4= ZnSO4+Cu_________
(2)盐桥中的阴离子向_________(填正极或负极)迁移。
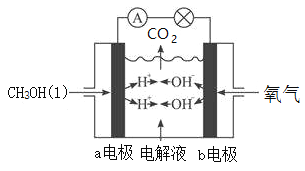
III.下图为甲醇(CH3OH)燃料电池装置,该装置能量转化率可达90%,当通入67.2L(标况下)氧气时,产生1306kJ电能,则甲醇液体的燃烧热的热化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com