


科目:高中化学 来源: 题型:
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B、某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
| C、常温常压下,1 mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA |
| D、1.8 g重水(D2O)中含有中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向含1mol碘化亚铁的溶液中通入标况下44.8L氯气:2Fe2++2I-+2Cl2=2Fe3++2I2+4Cl- |
| B、铝铵矾[NH4Al(SO4)2?12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| C、H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O |
| D、NaHCO3溶液水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
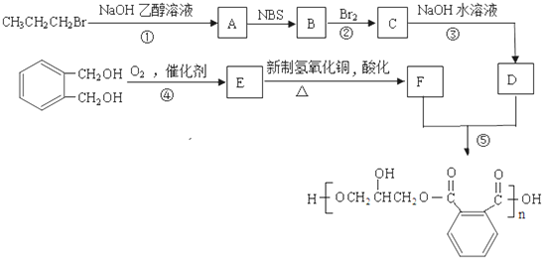
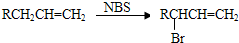
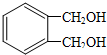 中的含氧官能团的名称为
中的含氧官能团的名称为 互为同分异构体的结构简式.
互为同分异构体的结构简式.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、都不正确 |
| C、④ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
| B、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| C、常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,则转移的电子数为2NA |
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com