
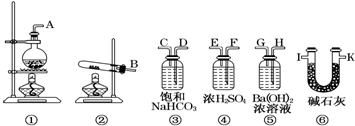
分析 根据装置图可知,为测定样品中Na2CO3的质量分数,先将样品在试管中加热,将生成气体通往氢氧化钡溶液中,根据氢氧化钡溶液质量的质量的增加可知二氧化碳的质量,根据二氧化碳的质量可知样品中碳酸氢钠的质量,进而确定碳酸钠的质量,再计算质量分数,为了防止空气的二氧化碳被氢氧化钡溶液吸收,在装有氢氧化钡溶液装置的后面再连接装有碱石灰的干燥管,据此答题.
解答 解:根据装置图可知,为测定样品中Na2CO3的质量分数,先将样品在试管中加热,将生成气体通往氢氧化钡溶液中,根据氢氧化钡溶液质量的质量的增加可知二氧化碳的质量,根据二氧化碳的质量可知样品中碳酸氢钠的质量,进而确定碳酸钠的质量,再计算质量分数,为了防止空气的二氧化碳被氢氧化钡溶液吸收,在装有氢氧化钡溶液装置的后面再连接装有碱石灰的干燥管,
(1)根据上面的分析可知,该实验所需要的装置是②⑤⑥,所选用装置的连接顺序是B接H,G接I,
故答案为:②⑤⑥;B接H,G接I;
(2)为防止倒吸,停止加热时,应先将B接口和H接口分开,
故答案为:应先将B接口和H接口分开;
(3)实验装置中盛碱石灰的U型管的作用是防止空气的二氧化碳被氢氧化钡溶液吸收而影响实验的准确性,
故答案为:防止空气的二氧化碳被氢氧化钡溶液吸收而影响实验的准确性;
(4)根据碳酸氢钠分解的方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑可知,生成a g CO2时,则分解掉的碳酸氢钠的质量为$\frac{84×2}{44}×ag$=$\frac{42}{11}a$g,所以W g样品中所含Na2CO3的质量分数为$\frac{Wg-\frac{42}{11}ag}{Wg}$=$\frac{11W-42a}{11W}$,
故答案为:$\frac{11W-42a}{11W}$.
点评 本题考查较为综合,以钠的化合物为载体,综合考查学生实验能力和分析能力,注意把握物质的性质以及实验原理,为解答该题的关键,题目难度中等.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:推断题
在下图所示的物质转化关系中,A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,且两种元素化合价的绝对值相等。常温下,C、F、K是无色无味的气体单质,D、H是固体单质。E是常见的两性氧化物。B、G是汽车尾气中的主要污染气体,所 含元素均为第二周期元素
含元素均为第二周期元素 。反应②常用于汽车尾气的处理。
。反应②常用于汽车尾气的处理。
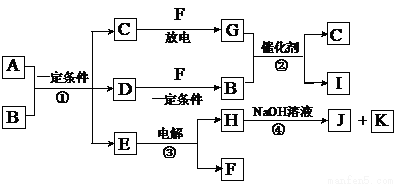
(1)C的电子式 。
(2)A的化学式 。
(3)反应③的化学方程式 。
(4)反应④的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 曲线a和b表示两个反应过程的反应热不同 | |
| B. | 曲线a一定表示反应是在无催化剂时的反应过程 | |
| C. | 增大压强,X的转化率一定增大 | |
| D. | 反应达平衡,升高温度,平衡常数K值一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1的三种溶液的pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等 | |
| C. | 25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大 | |
| D. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Mn | Fe | |
| 电离能 | I1 | 717 | 759 |
| (kJ•mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产过程中将NH3液化分离,减小氨气的浓度会导致化学平衡向左移动 | |
| B. | 合成氨工业中,使用铁催化剂可加快正反应速率,提高N2、H2的转化率 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 | |
| D. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
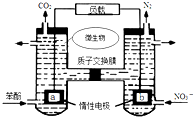
| A. | a电极发生还原反应 | |
| B. | H+由右室通过质子交换膜进入左室 | |
| C. | b电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 电池工作时,电流由a电极沿导线流向b电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com