
| A、该溶液中,K+、Fe2+、SO42-、Br-可以大量共存 |
| B、溶液pH=1时,由水电离出的氢离子浓度为1×10-13 mol/L |
| C、1L 0.1mol/L该溶液和足量的Zn充分反应,生成1.12L H2 |
| D、稀溶液中通SO2反应的离子方程式为:2SO2+H2O+2NO3-=2SO42-+2NO↑+2H+ |
| Kw |
| C(H+) |
| 10-14 |
| 0.1 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
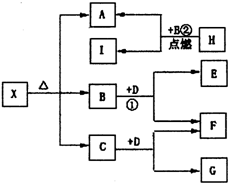 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.查看答案和解析>>
科目:高中化学 来源: 题型:
 将反应5IO3-+I-+6H+?3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流 计指针再次发生偏转.下列判断不正确的是( )
将反应5IO3-+I-+6H+?3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流 计指针再次发生偏转.下列判断不正确的是( )| A、开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 |
| B、开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、两次电流计指针偏转方向相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Mg2+、Ba2+、HCO3-、Cl- |
| B、Na+、Cu2+、Ca2+、SO42-、NO3- |
| C、CO32-、Mg2+、NH4+、SO42-、Cl- |
| D、K+、Na+、Cl-、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀盐酸反应 |
| B、灼热的炭与二氧化碳反应 |
| C、甲烷在氧气中燃烧 |
| D、Ba(OH)2?8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、香芹酮化学式为C9H12O |
| B、香芹酮可以发生加成反应、消去反应和氧化反应 |
| C、香芹酮能使酸性KMnO4溶液退色 |
| D、香芹酮分子中有3种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大.X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:
已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大.X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com