
| A. | 单质硅用于制造芯片和光导纤维 | |
| B. | 84消毒液的有效成分是NaClO | |
| C. | SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
分析 A.光导纤维主要成分是二氧化硅;
B.84消毒液中NaClO具有强氧化性,能够杀菌消毒;
C.SO2气体通入紫色石蕊试液中,溶液变为红色;
D.普通玻璃是混合物.
解答 解:A.光导纤维主要成分是二氧化硅,不是硅,故A错误;
B.84消毒液中NaClO具有强氧化性,能够杀菌消毒,是消毒液的有效成分,故B正确;
C.将SO2气体通入紫色石蕊试液中,溶液变为红色,可说明二氧化硫为酸性氧化物,不能说明其漂白性,故C错误;
D.普通玻璃的成分是二氧化硅、硅酸钙、硅酸钠,为混合物,故D错误;
故选:B.
点评 本题考查了物质的性质,熟悉相关物质的性质是解题关键,为常考查点,知道二氧化硫漂白原理,知道二氧化硫和次氯酸漂白性的不同,题目难度不大.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CO32-、NO3- | B. | Na+、Cl- | C. | Na+、NO3- | D. | Cl-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
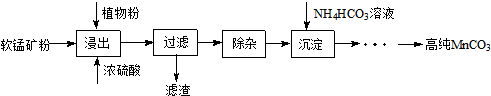
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:3 | B. | 3:8 | C. | 27:4 | D. | 4:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO2均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、四氯化碳、氨气均为电解质 | |
| D. | 福尔马林、水玻璃、氢氟酸、小苏打均为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
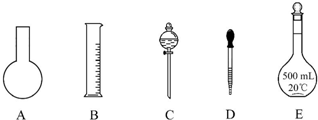
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
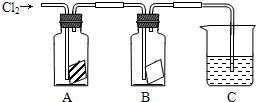
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com