
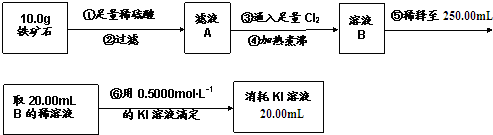
| A. | 步骤④中煮沸的作用是为了除去残留的氯气 | |
| B. | 步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 | |
| C. | 铁矿石中铁的百分含量为56% | |
| D. | 该铁矿石中若含氧为24%,则铁的氧化物的化学式为Fe2O3•3FeO |
分析 铁矿石和稀硫酸反应生成硫酸盐和水,然后过滤得到滤液A,向滤液中通入足量Cl2,Cl2具有强氧化性,能将Fe 2+氧化为Fe 3+,然后煮沸得到溶液B,将溶液B稀释,向溶液B中加入KI溶液,Fe 3+和碘离子发生氧化还原反应生成Fe 2+和I2,先根据碘离子和铁离子关系式计算铁离子的物质的量,根据铁原子守恒计算其质量分数,
A.煮沸可以将水中的气体赶走;
B.根据稀释液体和配制一定体积的溶液步骤分析所选择的仪器,包括加水稀释、容量瓶定容;
C.根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI),即:0.4000mol•L-1×0.025L=c(Fe3+)×0.02L,解得c(Fe3+)=0.5mol•L-1,根据元素守恒和化学反应方程式进行计算;
D.根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式.
解答 解:A.向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸后可以降低氯气的溶解度,赶走溶液中溶解的过量的Cl2,故A正确;
B.将原溶液稀释到250mL,需要使用的玻璃仪器仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,故B正确;
C.根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI),即:0.4000mol•L-1×0.025L=c(Fe3+)×0.02L,解得c(Fe3+)=0.5mol•L-1,所以铁元素的百分含量为:$\frac{0.5mol/L×0.25L×56g/mol}{10g}$×100%=70%,
故C错误;
D.铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:$\frac{70}{56}$:$\frac{24}{16}$=5:6,铁的氧化物的化学式为:Fe5O6,铁的氧化物的化学式可以为Fe2O3•3FeO,故D正确;
故选C.
点评 本题考查了探究铁矿石中氧元素和铁元素的含量的方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力和计算能力;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1000 mL,514.00 g | B. | 480 mL,198.72 g | ||
| C. | 500 mL,207.00 g | D. | 任意规格,207.00 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+) | |
| B. | 该溶液中:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-) | |
| C. | 加水稀释该溶液,恢复至原温度,pH增大,Kw不变 | |
| D. | 该溶液pH约为13的原因:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
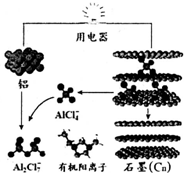 2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用AlCl4-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时的阳极反应为:Cn+AlCl4--e-=Cn AlCl4 | |
| C. | 放电时的负极反应为:Al-3e-+7 AlCl4-═4A12C17- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com