
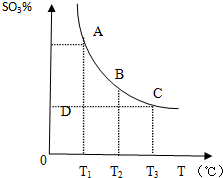
 运用化学原理研究元素及其化合物的反应有重要意义.
运用化学原理研究元素及其化合物的反应有重要意义.分析 (1)①若在恒温、恒压条件下向上述平衡体系中通入氦气,容器体积增大,则反应物和生成物分压减小,减小压强正逆反应速率都减小,平衡向气体体积增大的方向移动;
②温度为T1时反应进行到状态D时,该温度下要使该反应达到平衡状态,需要三氧化硫含量增大才能实现;
(2)①为了提高SO2的利用率,应该使平衡正向移动,但不能通过增大二氧化硫浓度实现;
②增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,增大氧气物质的量能提高二氧化硫转化率.
解答 解:(1)①若在恒温、恒压条件下向上述平衡体系中通入氦气,容器体积增大,则反应物和生成物分压减小,减小压强正逆反应速率都减小,平衡向气体体积增大的方向移动,即向逆反应方向移动,
故答案为:减小;逆向;
②温度为T1时反应进行到状态D时,该温度下要使该反应达到平衡状态,需要三氧化硫含量增大才能实现,平衡正向移动,故答案为:正向;
(2)①a.升高温度,三氧化硫含量降低,说明平衡逆向移动,不能提高二氧化硫利用率,故错误;
b.降低温度,三氧化硫含量增大,平衡正向移动,提高二氧化硫利用率,故正确;
c.增大n(O2)与 n(SO2)之比,平衡正向移动,提高二氧化硫利用率,故正确;
d.减小n(O2)与 n(SO2)之比,平衡逆向移动,不能提高二氧化硫利用率,故错误;
e.增大压强,平衡正向移动,提高二氧化硫利用率,故正确;
f.减小压强,平衡逆向移动,降低二氧化硫利用率,故错误;
故选bce;
②增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,所以采用常压;增大氧气物质的量能提高二氧化硫转化率,所以采用n(SO2)与 n(O2)之比为1:1.6投料,
故答案为:增大压强对提高SO2转化率无显著影响,且对设备要求更高,导致增加成本,所以SO2的催化氧化采用常压而不是高压;增大氧气浓度从而提高二氧化硫的转化率.
点评 本题考查化学平衡移动影响因素,为高频考点,侧重考查学生分析判断能力,明确浓度、温度、压强对化学平衡移动影响原理是解本题关键,注意恒温恒容条件下充入稀有气体、恒温恒压条件下充入稀有气体区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
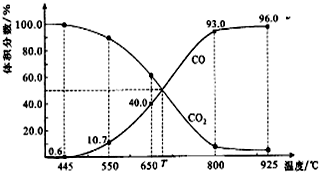
| A. | 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内气体压强保持不变 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器内通入少量氢气,则V(放氢)>V(吸氢) | |
| D. | 若降温,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | Y | ||
| Z | W | M |
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
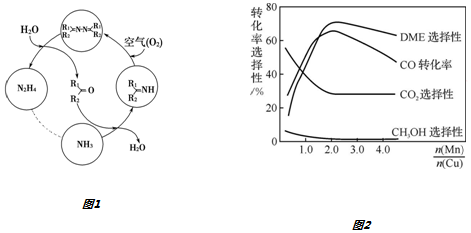
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 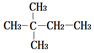 | B. | 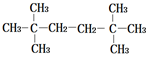 | ||
| C. | CH3CH2CH2CH2CH2CH3 | D. | CH3CH2CH2CH2CH2CH2CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com