
| A. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应 | |
| C. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 | |
| D. | 双氧水、高锰酸钾溶液可以完全杀死埃博拉病毒,其消毒原理与漂白粉消毒的原理相似 |
分析 A.二氧化硅具有良好的光学特性,为酸性氧化物,能够与强碱反应;
B.丁达尔效应是胶体特有的性质;
C.二氧化碳是导致温室效应的主要原因;
D.依据过氧化氢、高锰酸钾、次氯酸钙的强氧化性解答.
解答 解:A.二氧化硅具有良好的光学特性,是制造光导纤维主要原料,为酸性氧化物,能够与强碱反应生成硅酸盐,所以光导纤维遇强碱会“断路”,故A正确;
B.丁达尔效应是胶体特有的性质,水玻璃为硅酸钠的水溶液,不具有丁达尔效应,故B错误;
C.二氧化碳是导致温室效应的主要原因,则用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应,故C正确;
D.过氧化氢、高锰酸钾、次氯酸钙都具有强的氧化性,能够使蛋白质变性,可以杀菌消毒,原理相同,故D正确;
故选:B.
点评 本题考查物质的性质及用途,为高频考点,把握物质的组成和性质、发生的反应为解答关键为解答该题的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:a<c<d<e | |
| B. | 气态氢化物的稳定性e<b<c | |
| C. | 最高价氧化物的水化物酸性b>e | |
| D. | c和d形成的化合物溶于水后溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
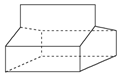 按要求回答问题:
按要求回答问题: ;
;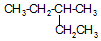 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
. ,如果要合成
,如果要合成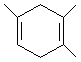 ,所用的原料可以是
,所用的原料可以是 查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 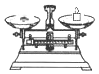 |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 组成 | 体积比 |
| 1 | ||
| 2 | ||
| 3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;R2Q2与X2Q反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;R2Q2与X2Q反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com