
【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
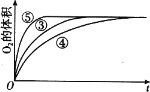
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。
【答案】(1)降低了活化能(2分)
(2)探究浓度对反应速率的影响 (2分)
向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(2分)
(3)2H2O2![]() O2↑+2H2O(2分)
O2↑+2H2O(2分)
(4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 (2分)
【解析】
(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率,故答案为:改变反应途径,降低了活化能;
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(3)过氧化氢在催化剂作用下分解生成水和氧气,该反应为2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(4)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。


科目:高中化学 来源: 题型:
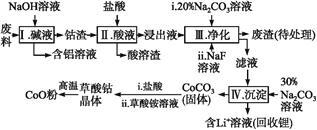
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是__________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______。
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
①加热到210 ℃时,固体质量减轻的原因是__________。
②经测定,加热到210~290 ℃过程中的生成物只有CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的工具和基础,下列有关化学用语的表达正确的是
A. H2S 的电离方程式:H2S=2H++S2-
B. 氯化铵的电子式:![]()
C. HClO的结构式为:H-O-Cl
D. 反应的电子转移情况: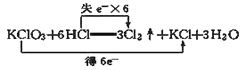
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是
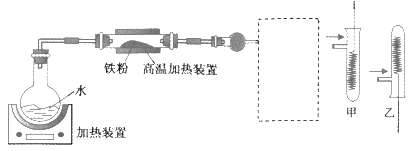
A. 高温加热装置中发生的反应为3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
B. 虚线框处宜选择的装置是甲
C. 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D. 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.分散质粒子能做无规则运动
B.光线透过时能观察到光亮的通路
C.静置后既不分层,也无沉淀产生
D.分散质粒子直径在10-7~10-9m之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为NH4+。下列说法正确的是

A. a连接电源的正极
B. Pt电极B上发生的电极反应为2H2O-4eˉ=O2↑+4H+
C. 当NO吸收柱中产生1mol SO32ˉ时,理论上处理的NO气体的体积为8.96L(标准状况)
D. 图中的离子交换膜应为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中每一个方框内的字母代表一种反应物或生成物:

已知:气态烃C的密度是同温同压下H2密度的13倍;气态烃F的产量是衡量一个国家化工产业发展水平的重要标志;物质G的相对分子质量是C的3倍,和H反应时产生明亮而带浓烈黑烟的火焰;I常温下是一种能使澄清石灰水变浑浊的无色无味气体。
根据以上描述,回答下列问题:
(1)写出下列物质的结构简式或化学式:A:__________;C:________;F:__________。
(2)完成下列反应的化学方程式:
③C在高温高压催化剂条件下聚合生成G:______________________________________
④G和F在催化剂存在时共热:______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为:2K2S2+KI3 ![]() K2S4+3KI,装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )
K2S4+3KI,装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )

A. 闭合K时,K+从右到左通过离子交换膜
B. 闭合K时,A的电极反应式为:3I--2e-===I![]()
C. 闭合K时,X的电极反应式为:2Cl--2e-===Cl2↑
D. 闭合K时,当有0.1 mol K+通过离子交换膜,X电极上产生标准状况下气体1.12 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com