
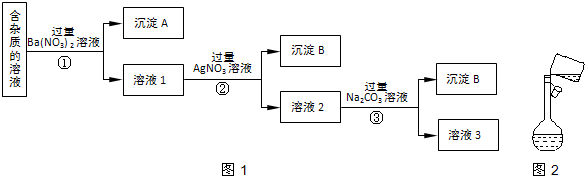
分析 由实验流程可知,加入过量的Ba(NO3)2,生成BaSO4、BaCO3沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,以此解答(1)~(4);
(5)①结合m=nVM计算质量,结合溶液配制的操作计算、称量、溶解、转移、洗涤、定容、摇匀等分析;
②图中转移液体应引流;
③用胶头滴管定容时,不小心滴水滴过了刻度线,实验失败;
④结合c=$\frac{n}{V}$及不当操作导致n或V的变化分析.
解答 解:由实验流程可知,加入过量的Ba(NO3)2,生成BaSO4、BaCO3沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,
(1)加入过量的Ba(NO3)2,Na2SO4、Na2CO3和Ba(NO3)2反应生成BaSO4、BaCO3沉淀,
故答案为:BaSO4、BaCO3;
(2)滤液1中含氯离子,加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,反应的离子方程式为:Ag++Cl-═AgCl↓,故答案为:Ag++Cl-═AgCl↓;
(3)①②③中均进行的分离是把不溶性物质和可溶性物质分离,故为过滤,故答案为:过滤;
(4)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加热蒸发、冷却结晶、过滤得到硝酸钠,故答案为:Na2CO3;HNO3;
(5)①制备500mL 0.4mol/L的NaNO3溶液,需要500mL容量瓶,则需要硝酸钠的质量为0.5L×0.4mol/L×85g/mol=17.0g,配制的步骤依次为计算、称量、溶解、转移、洗涤、定容、摇匀等操作,故第4步为转移,
故答案为:17.0;e;
②向容量瓶中转移液体需要用玻璃棒引流,故答案为:未用玻璃棒引流;
③若用胶头滴管定容时,不小心滴水滴过了刻度线,应该采取的处理方法是重新配制,故答案为:重新配制;
④a.没有洗涤烧杯和玻璃棒,n减小,由c=$\frac{n}{V}$可知,浓度减小,故选;
b.定容时,俯视刻度线,V偏小,由c=$\frac{n}{V}$可知,浓度增大,故不选;
c.洗涤后的容量瓶中残留少量蒸馏水,n、V均不发生变化,对实验无影响,故不选;
故答案为:a.
点评 本题考查混合物分离提纯的综合应用及溶液配制,为高频考点,把握流程中的反应及物质的性质、混合物分离方法为解答的关键,侧重分析、应用能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①和③ | C. | ①和④ | D. | ②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶于水在电流作用下电离成钠离子和氯离子 | |
| B. | 电离时生成的阳离子有H+ 的化合物叫做酸 | |
| C. | CO2 的水溶液能导电,所以CO2 是电解质 | |
| D. | 固体NaCl不导电,但NaCl是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 | |
| B. | 炼铁:用CO在高温下还原铁矿石中的铁 | |
| C. | 制钠:电解饱和NaCl溶液 | |
| D. | 制镁:工业上电解氧化镁来制备镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 6 mol/L盐酸 | C. | 醋酸钠固体 | D. | 金属钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com