

| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②为原电池,总反应是:Fe+2Fe3+=3 Fe2+ | |
| C. | 图③所示柱形图,纵坐标表示第二周期元素最高正价随原子序数的变化 | |
| D. | 图④所示曲线,表示该反应是放热反应 |
分析 A.根据电流的方向判断电源的正负极,精炼铜时粗铜做阳极;
B.铁比铜活泼,Fe为原电池的负极;
C.O、F元素无正价;
D.反应物能量比生成物高,反应放热.
解答 解:A.根据电流的方向可知a为电解池的阳极,则用来精炼铜时,a极为粗铜,电解质溶液为CuSO4溶液,故A正确;
B.Fe比Cu活泼,Fe为原电池的负极,发生的总反应为:Fe+2Fe3+=3Fe2+,故B正确;
C.第二周期元素中O、F无正价,故C错误;
D.根据图象可知,反应物能量比生成物高,该反应为放热反应,故D正确;
故选C.
点评 本题考查较为综合,涉及原电池及电解原理的应用、元素周期律、化学反应与能力变化等知识,明确原电池、电解池工作原理为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
 通过传感器可以监测空气中甲醛的含量.一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是( )
通过传感器可以监测空气中甲醛的含量.一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是( )| A. | a为电池的正极,发生还原反应 | |
| B. | b极的电极反应为HCHO+H2O-4e-═CO2+4H+ | |
| C. | 传感器工作过程中,电解质溶液中硫酸的浓度减小 | |
| D. | 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
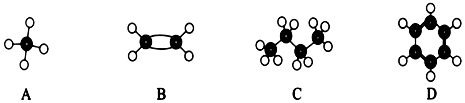
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯 | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸(  )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,测定一定物质的量浓度的某NaA溶液的pH,pH>7,可以说明HA是弱酸 | |
| B. | 在一块镀锡铁板刻一划痕,滴加酸化的食盐水浸泡及KSCN溶液,溶液颜色没有变化,判断其具有好的耐腐蚀性 | |
| C. | 在氯化银的悬浊液中加入碘化钠溶液,沉淀颜色不变,说明氯化银的溶解度比碘化银大 | |
| D. | 在酸碱中和滴定中,用标准氢氧化钠溶液测定醋酸溶液的浓度时,用甲基橙做指示剂对滴定终点的判断比用酚酞的更准确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-3-乙基戊烷 | B. | 4-甲基-3-乙基戊烷 | ||
| C. | 3-异丙基戊烷 | D. | 1,1-二甲基-2-乙基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com