
将Al2O3和Fe2O3的混合物进行如下实验,试写出各步操作所发生反应的离子方程式:
①将混合粉末用硫酸充分溶解:
②在溶液中用过量浓氨水中和,得到沉淀:
③在沉淀中滴加KOH溶液,充分反应滤出沉淀得:
④往滤液中通入足量CO2: 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 万全沉淀的pH | 4.77 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源:2011届福建省宁德市高三普通高中毕业班质量检查(理综)化学部分 题型:填空题
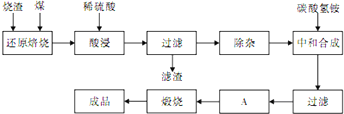
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下: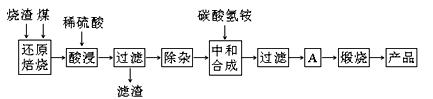
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第9讲 金属及其化合物练习卷(解析版) 题型:实验题
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是____________________________________。
(2)将MnO4-氧化Fe2+的离子方程式补充完整:
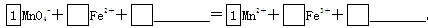
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的:________。
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
① 向 Ⅲ 的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是__________。
② Ⅳ 中加入MnSO4的目的是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省宁德市毕业班质量检查(理综)化学部分 题型:填空题
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
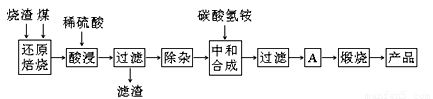
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
|
氢氧化物 |
Al(OH)3 |
Mg(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀的pH |
3.10 |
8.54 |
2.01 |
7.11 |
|
完全沉淀的pH |
4.77 |
11.04 |
3.68 |
9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com