
 .
.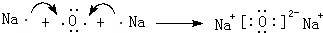 .
.分析 X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大,由于X为主族元素,则X为H元素;Y的氢化物分子中有3个共价键,说明最外层电子数为5,Y处于ⅤA族,X、W同主族,处于ⅠA族,Y的原子序数小于W、大于氢元素,故Y为N元素、W为Na元素;Y、Z为同周期的相邻元素,W原子的质子数等于Y、Z原子最外层电子数之和,Z的原子最外层电子数为11-5=6,原子序数小于Na元素、大于N元素,故Z为O元素,据此解答.
解答 解:X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大,由于X为主族元素,则X为H元素;Y的氢化物分子中有3个共价键,说明最外层电子数为5,Y处于ⅤA族,X、W同主族,处于ⅠA族,Y的原子序数小于W、大于氢元素,故Y为N元素、W为Na元素;Y、Z为同周期的相邻元素,W原子的质子数等于Y、Z原子最外层电子数之和,Z的原子最外层电子数为11-5=6,原子序数小于Na元素、大于N元素,故Z为O元素.
(1)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物为NH3,含有极性共价键和非极性共价键的化合物是双氧水,双氧水分子的电子式为 ,
,
故答案为:NH3; ;
;
(2)由H、N、O所形成的常见离子化合物是NH4NO3,W的最高价氧化物对应的水化物为NaOH,两种化合物的浓溶液混合共热的离子反应方程式为 NH4++OH-?NH3↑+H2O,H与Na形成的化合物为NaH,属于离子化合物,将该化合物溶于水,发生反应生成氢氧化钠与氢气,反应化学方程式为NaH+H2O═NaOH+H2↑,其中水中氢元素化合价降低,水做氧化剂,
故答案为:NH4NO3;NH4++OH-?NH3↑+H2O;氧化剂;
(3)用电子式表示W与Z形成Na2O化合物的过程: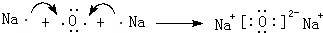 ,
,
故答案为: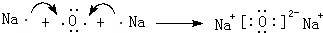 ;
;
(4)X与Y可以形成N2H4分子,它是一种可燃性的液体,可与空气形成燃料电池,产物无污染,电解质溶液常选用20%~30%的KOH溶液,则反应生成氮气与水,该燃料电池放电时,碱性条件下,氧气在正极上得电子生成氢氧根离子,则正极的电极反应式为O2+2H2O+4e-=4OH-,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,
故答案为:O2+2H2O+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑.
点评 本题考查结构性质位置关系、常用化学用语,难度中等,注意掌握常用常用化学用语的书写,(2)中根据水解原理理解NaH与水的反应.


科目:高中化学 来源: 题型:选择题
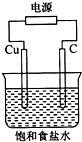
| A. | 石墨电极与直流电源负极相连 | |
| B. | 铜电极的反应式为:2H++2e-═H2↑ | |
| C. | 氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移 | |
| D. | 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4→CuSO4 | B. | MnO4-→Mn2+ | C. | Fe→FeCl3 | D. | NaNO3→N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )
) .由甲苯生成甲的反应类型是取代反应.
.由甲苯生成甲的反应类型是取代反应. +HOCH2CH2Cl$→_{△}^{浓硫酸}$
+HOCH2CH2Cl$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| B. | 任何条件下,等物质的量的乙烯(C2H4)和一氧化碳所含的分子数必然相等 | |
| C. | 10g一氧化碳气体和10g氧气的体积相等 | |
| D. | 同温同压下,等体积的物质所含的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com