
【题目】设![]() 表示阿伏加德罗常数的值,下列判断正确的是( )
表示阿伏加德罗常数的值,下列判断正确的是( )
A.常温下,![]() 的盐酸溶液中,由水电离的
的盐酸溶液中,由水电离的![]() 个数为
个数为![]()
B.标准状况下,氧原子总数为![]() 的
的![]() 和
和![]() 的混合气体,其体积为
的混合气体,其体积为![]()
C.常温下,![]() 铁分别与足量氯气和稀硝酸反应,转移的电子数目均为
铁分别与足量氯气和稀硝酸反应,转移的电子数目均为![]()
D.![]() 乙醇溶液中所含
乙醇溶液中所含![]() 数目为NA
数目为NA
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】(1) A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
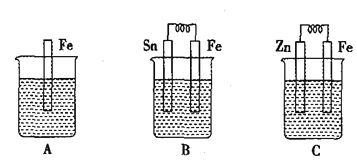
①B中Sn极的电极反应式为__________,Sn极附近溶液的pH_____(填“增大”、“减小”或“不变”)。
②C中总反应离子方程式为_____________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是______(填“a”或“b”)电极,该极的电极反应是_______。
②电池工作一段时间后电解质溶液的pH____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为:____。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:_______。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团:___________。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式_____________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
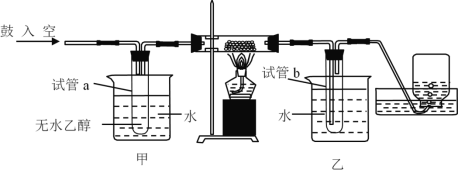
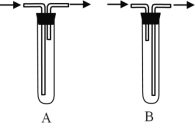
(1)试管a中导管连接方式为___________(填A或B)。
(2)实验过程中铜网出现黑色和红色交替的现象,其中铜丝由黑变红的反应方程式为_________。
(3)反应进行一段时间后,若要检验试管b中收集的物质,进行的操作为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下,一定能大量共存的是
A.能使pH试纸变蓝的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.由水电离产生的 c![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.在![]()
![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.常温下,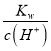
![]() 的溶液中:
的溶液中:![]() 、HCO3-、
、HCO3-、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
诺氟沙星为喹诺酮类抗生素,其合成路线如下:

回答下列问题:
(1)化合物A的名称是____________。
(2)诺氟沙星分子中含氧官能团的名称为____________。
(3)C生成D,H生成诺氟沙星的反应类型分别是___________、___________。
(4)F的结构简式为_______________。
(5)G生成H的化学方程式为__________________。
(6)有机物X比B分子少一个CH2原子团,且含有酯基和![]() 结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
(7)参照上述合成路线写出由有机物![]() 、B为有机原料合成
、B为有机原料合成 的路线图______________(无机试剂任选)。
的路线图______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是
①CH3CH2CH2Br在碱性溶液中水解 ②甲苯在催化剂作用下与Cl2发生苯环上的取代反应 ③2-氯丁烷与NaOH乙醇溶液共热反应 ④ 在催化剂的存在与氢气完全加成 ⑤异戊二烯(
在催化剂的存在与氢气完全加成 ⑤异戊二烯( )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
A. ①②③ B. ①②④ C. ②③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往xg铁铜的混合粉末中加入一定体积某浓度的2.00mol·L-1FeCl3溶液,充分反应后剩余固体的质量与加入FeCl3溶液的体积存在如下关系:
加入FeCl3溶液体积(mL) | 100 | 200 | 300 | 400 |
剩余固体质量(g) | 14.8 | 9.20 | 3.20 | 0 |
下列说法不正确的是
A.x=20.6
B.加入FeCl3溶液300mL充分反应后,剩余固体只有Cu
C.混合粉末中Fe和Cu质量之比为35:16
D.加入FeCl3溶液400mL充分反应后的溶液,还能溶解铁粉8.40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。
(l)用CH4还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
③H2O(g)= H2O(l) △H=-44.0kJ·mol-1
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式为_________________。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。

①010min内,以CO2表示的平均反应速率v(CO2)=_______________。
②0~10min,1020 min,3040 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为_________,其值是___________________。
③计算反应达到第一次平衡时的平衡常数K=____________。
④第10min时,若只改变了影响反应的一个条件,则改变的条件为______(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
⑤20~30min、4050 min时体系的温度分别为T1和T2,则T1_____T2(填“> “<”或“=”), 判断的理由是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com