
����Ŀ��ijǿ������ҺX�п��ܺ���Ba2+��Al3+��NH4+��Fe2+��Fe3+��CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ��������£�
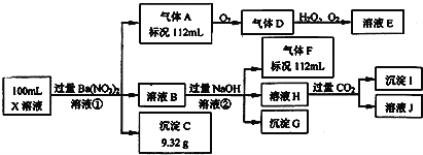
����������Ϣ���ش��������⣺
��1����������������ʵ�鲻��ȷ����ҺX���Ƿ��е����������ӷֱ��� ����֤�����������Ƿ���ڵļ�ʵ�����Ϊ____ __��
��2�������ӷ��̱������з�Ӧ��
������������A�� ������������ҺH�� ��
��3��������������������Ũ��Ϊ2mol/L��������l0mlʱ��ʼ����������55mlʱ���������ﵽ���ֵ0.03mol�������μӳ����������ֲ��䣬����ٵμӳ��������ܽ⣬��60mlʱ����������Ϊ0.025mol�ұ��ֲ��䣬��ԭ��Һ��c��Fe2+��Ϊ mol/L��c��Fe3+��Ϊ mol/L��c��Cl����Ϊ mol/L��������Щ���Ӳ����ڣ�����0mol/L��
���𰸡���1��Fe3+��Cl����ȡ������ˮ�������μ�������Ba��NO3��2��Һ�����ã�ȡ�ϲ���Һ���μ������ữ��AgNO3��Һ�����а�ɫ���������������Cl�������ް�ɫ�������������� ��
��2���� 3Fe2++4H++NO3��=3Fe3++NO��+2H2O ��Al3++4OH��=AlO2��+2H2O ��
��3��0.15��0.1��0.4
��������
������������������Ϣ֪��Һ��ǿ���ԣ�ǿ������Һ�������Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ�������������Ӧ���ɶ��������ˮ������һ���������CO32-��SO32-����������������ᱵ���ɳ����������Ӻ���������ӷ�Ӧ�������ᱵ������˵��һ������SO42-���������ᱵ���������Լ�����������ӵ����ʵ���Ϊ0.04mol��Ũ����=0.4mol/L������SO42-���Ӿ�һ������Ba2+���ӣ�����A������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ�һ��ΪFe2+����������������һ������NO3-��������ҺB�м������NaOH��Һ����������F����FΪNH3��˵����Һ�к���NH4+����ҺB�л��������ӣ���������������Һ���ɺ��ɫ��������������������Һ��һ�������������ӣ��������ӱ������������������ӣ�����ԭ��Һ�в�һ����������������ҺH��ͨ��CO2���壬���ɳ���K����KΪAl(OH)3����˵����ҺH�к���ƫ�����ƣ�����ԭ��Һ�к��������ӣ������������������Һ��Ӧ����ƫ����������������ԭ��Һ��һ������Al3+��NH4+��Fe2+ ��SO42����һ������Ba2+��CO32����SO32����NO3��������ȷ����ΪFe3+��Cl�����ݴ��������ת�����в���H�����ӷ���ʽΪAl3++4OH����AlO2��+2H2O��
��1����������������ʵ�鲻��ȷ����ҺX���Ƿ��е����������ӷֱ���Fe3+��Cl������Һ��һ������SO42�����������Һ���Ƿ���Cl����Ӧ��ֹ������ĸ��ţ���֤��Cl���Ƿ���ڵļ�ʵ�����Ϊȡ������ˮ�������μ�������Ba��NO3��2��Һ�����ã�ȡ�ϲ���Һ���μ������ữ��AgNO3��Һ�����а�ɫ���������������Cl�������ް�ɫ�������������� ��
��2������Fe2����H����NO3����Ӧ����Fe3����NO�����ӷ���ʽΪ3Fe2++4H++NO3��=3Fe3++NO��+2H2O���������������������������Һ��Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪAl3++4OH��=AlO2��+2H2O��
��3�����ݷ�Ӧ��3Fe2++4H++NO3��=3Fe3++NO��+2H2O ֪���ɱ�״����112Mlno,���ʵ���Ϊ0.005mol��Fe2+�����ʵ�����0.015mol������ԭ��Һ��c��Fe2+��=0.15mol/L����������������60mlʱ������������Ϊ0.025mol�����������������ʵ�����0.025mol��������Ԫ���غ㣬����Fe3+�����ʵ�����0.01mol������ԭ��Һ��c��Fe3+��0.1mol/L�����������Ũ����0.4mol/L��NH4+�������ʵ�����0.005mol��Ũ����0.05mol/L��Al3+�����ʵ�����0.005mol��Ũ����0.05mol/L�����ݵ���غ�֪2c��Fe2+��+3c��Fe3+��+3c��Al3+��+c��NH4+��=��2��0.15+3��0.1+3��0.05+0.05��mol/L=0.8mol/L��2c��SO42-��=0.8mol/L������c��Cl-��Ϊ0��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȥ���������е�����(����������Ϊ����)�������Լ�����ȷ����
A. KNO3��Һ(K2SO4)������Ba(NO3)2��Һ B. CaCO3��ĩ(CaCl2)����������
C. Cu��(Zn��)���������� D. CO2(O2)�����ȵ�ͭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȱij����Ԫ��ʱ��������ƶѪ����Ԫ������ ��
A���� B���� C���� D��п
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.��̼Ԫ����ɵ�����һ���Ǵ�����
B.���ʯ��ʯī����ͬ��Ԫ����ɣ�������Ǿ�����ͬ������
C.ʯīת��Ϊ���ʯ�ķ�Ӧ����������ԭ��Ӧ
D.C60���·��ֵ�һ��̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC10H14�Ķ�ȡ����������������������������������ܵĽṹ�У� ��
A. 6 B. 9 C. 15 D. 22
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����ͬ����������ǣ� ��
A. ʯī����ʯ B. ˮ������ C. �������Ҵ� D. ��ͭ��ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����;���Ʊ�����Ĺ��̣���Ӧ�����ԣ�������˵������ȷ���ǣ� ��

A��;��������O2Ũ�ȿ����SO2ת����
B����l mol H2SO4��Ũ��Һ������NaOH��Ӧ���ų���������Ϊ�к���
C��;������SO2��SO3����������������
D������Hl����H2+��H3����2H2O2��aq��=2H2O��1�� +O2 ��g��Ϊ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013��8��6�գ���ŷ�����ҵ̸��Э����ʽ��Ч��Ϊ�ҹ�������������Դ�ķ�չ������ƶ����ã�������ǹ����ҵ����Ҫ���ϣ�����˵����ȷ���ǣ� ��
A.�費����Ϊ����Դ�����IJ���
B.�費������ͬ�����̼�γɻ�����
C.���������������ӻ�����
D.��ȡ����Դ��һ��Ҫ������ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH��10��X��Y���ּ���Һ��1 mL���ֱ�ϡ����100 mL����pH����Һ�����V���Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A��X��Y���ּ���Һ�����ʵ����ʵ���Ũ��һ�����
B.ϡ�ͺ�X��Һ�ļ��Ա�Y��Һ�ļ���ǿ
C.�ֱ���ȫ�к�X��Y�����ּ���Һʱ������ͬ
Ũ����������Vx��Vy
D.��8��a��10����X��Y��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com