
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。
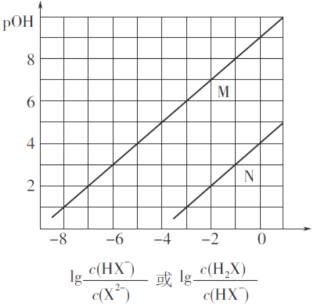
下列叙述正确的是
A. 曲线N表示pOH与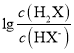 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
【答案】D
【解析】
Na2X溶液中,X2-分步水解,以第一步水解为主,则Kh1(X2-)>Kh2(X2-),碱性条件下,则pOH相同时, >
>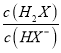 ,由图象可知N为pOH与lg
,由图象可知N为pOH与lg 的变化曲线,M为pOH与lg
的变化曲线,M为pOH与lg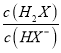 变化曲线,当lg
变化曲线,当lg 或lg
或lg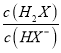 =0时,说明
=0时,说明 或
或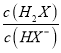 =1,浓度相等,结合图像可计算水解常数并判断溶液的酸碱性。
=1,浓度相等,结合图像可计算水解常数并判断溶液的酸碱性。
A.由以上分析可知,曲线N表示pOH与lg 的变化曲线,故A错误;B.由曲线M可知,当lg
的变化曲线,故A错误;B.由曲线M可知,当lg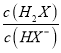 =0时,
=0时,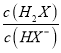 =1,pOH=9,c(OH-)=10-9mol/L,则Kh2(X2-)=
=1,pOH=9,c(OH-)=10-9mol/L,则Kh2(X2-)=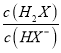 ×c(OH-)=1×10-9;由曲线N可知,当lg
×c(OH-)=1×10-9;由曲线N可知,当lg =0时,
=0时, =1,pOH=4,c(OH-)=10-4mol/L,Kh1(X2-)=
=1,pOH=4,c(OH-)=10-4mol/L,Kh1(X2-)= ×c(OH-)=1×10-4,则HX-的电离平衡常数Ka2=
×c(OH-)=1×10-4,则HX-的电离平衡常数Ka2=![]() =
=![]() =1×10-10,则NaHX溶液中HX-的水解程度大于电离程度,溶液中c(H2X)>c( X2-),故B错误;C.混合液中存在电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(HX-)+2c(X2-)+c(OH-),则当混合溶液呈中性时,c(Na+)=c(Cl-)+c(HX-)+2c(X2-),故C错误;D.由曲线N可知,当lg
=1×10-10,则NaHX溶液中HX-的水解程度大于电离程度,溶液中c(H2X)>c( X2-),故B错误;C.混合液中存在电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(HX-)+2c(X2-)+c(OH-),则当混合溶液呈中性时,c(Na+)=c(Cl-)+c(HX-)+2c(X2-),故C错误;D.由曲线N可知,当lg =0时,
=0时, =1,pOH=4,c(OH-)=10-4mol/L,则Kh1(X2-)=
=1,pOH=4,c(OH-)=10-4mol/L,则Kh1(X2-)= ×c(OH-)=1×10-4,故D正确;故答案为D。
×c(OH-)=1×10-4,故D正确;故答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行可逆反应:A(g)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到该条件下的最大限度的是( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到该条件下的最大限度的是( )
①容器内气体的压强
②混合气体的密度
③混合气体的平均相对分子质量
④v正(B)=2v逆(C)
A.只有④B.②③C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法中正确的是
A. 28g晶体硅中含有Si—Si键的个数为2NA
B. 12g石墨晶体中含有C—C键的个数为3NA
C. 31g白磷中含有P—P键的个数为NA
D. SiO2晶体中1molSi可与O形成2NA个共价键(Si—O键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
(1)实验1、2的目的是研究__________因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________。
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______。
(3)若用实验证明你的猜想/span>,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)玻璃中含有B,刻蚀玻璃的化学方程式为___。
(2)沉淀C的成分是___,溶液D中存在较多的阴离子是___。
(3)步骤③所加入的试剂是___,生成沉淀F的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
A. 2a2=a1=197 kJ B. 2a2<a1<197 kJ
C. a2>a1>197 kJ D. 197 kJ>a1=2a2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:

下列说法不正确的是
A. 合成气的主要成分为CO和H2
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. ①→②吸收能量
D. Ni在该反应中做催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,A、B、C含有相同元素甲,一定条件下可以发生如下转化(水参与的反应,水未标出)。
![]()
(1)符合上述转化关系的A、X、B、C为____________________(填字母代号)
a.NaOHCO2Na2CO3NaHCO3 b.NaO2Na2ONa2O2
c.NH3 O2 NO NO2 d.FeCl2 FeCl2 FeCl3
(2)X为无色无味能使澄清石灰水变浑浊的气体,则C为_________________(填化学式)。若B中混有少量C杂质,除杂的化学方程式为_________________。
(3)C为红棕色气体,则A是_______或________(填化学式),若A的水溶液显碱性,写出A→B的化学方程式______________________________,B和C可相互转化,写出C→B的化学方程式_____________________________。
(4)若C为淡黄色固体,则B为___________,写出C在潜水艇中作为供氧剂牵涉的两个反应方程式__________、________。
(5)除(1)涉及的转化外,再写出一组符合转换关系的A、X、B、C ____ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Cu和CuO的混合物中加入0.6 L2.0 mol/L的稀硝酸,混合物完全溶解,同时生成标准状况下NO 4.48 L。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,将沉淀洗涤,充分灼烧后得32.0 g固体。求:
(1)混合物中Cu的质量是____________。
(2)混合物消耗HNO3的物质的量是____________。
(3)NaOH溶液的体积是____________。
(4)Cu2+完全反应后,溶液中NO3-的物质的量浓度是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com