
可以把6种无色溶液:乙醇、苯酚、Na2CO3溶液、AgNO3溶液、KOH溶液、氢硫酸,区分的试剂是
| A.新制碱性Cu(OH)2悬浊液 | B.FeCl3溶液 |
| C.BaCl2溶液 | D.酸性KMnO4溶液 |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:实验题
实验室需要0.2mol/L CuSO4溶液250ml,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4·5H2O) ②4mol/L CuSO4溶液
(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种仪器是________,在使用该仪器前必须进行的操作是 。
(2)若用胆矾晶体进行配制,需用托盘天平称取CuSO4· 5H2O的质量为________g;如果用4mol/L的CuSO4溶液稀释配制,需用量筒量取___________ml4mol/L CuSO4溶液。
(3)实验室用4mol/L的硫酸铜溶液稀释配制溶液所需的实验步骤有:
其中正确的操作顺序为
①往烧杯中加入约100ml水进行初步稀释,冷却至室温
②用量筒量取一定体积4mol/L 的硫酸铜溶液于一烧杯中
③计算所需4mol/L 硫酸铜溶液的体积
④将溶液颠倒摇匀后转存于试剂瓶
⑤加水至液面离容量瓶1-2cm处改用胶头滴管进行定容
⑥洗涤烧杯和玻璃棒2-3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
⑦将溶液转移入容量瓶
(4)配制溶液过程中,如果出现以下情况,对结果有何影响(填“偏高”、“偏低”或“无影响”)
A.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
B.定容时俯视刻度线
C.容量瓶未干燥即用来配制溶液
(5)实验过程中用到蒸馏水。如图为实验室制取蒸馏水的装置示意图。图中的两处明显的错误是 ______________________________;_______________________________。实验时A中除加入少量自来水外,还需加入少量___ ____,其作用是防止暴沸。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案。(忽略锌镀层的氧化)甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。
(1)甲同学的方案是否可行,说出理由: 。
乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:
(2)配制5%的盐酸1 L (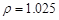 g/cm3 ),需取用36.5% (
g/cm3 ),需取用36.5% (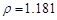 g/cm3 )的盐酸 mL
g/cm3 )的盐酸 mL
(保留一位小数)。
(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为 cm。丙同学的方案:通过如图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度。己称得镀锌铁皮质量为18.200g。
(4)实验所用称量仪器为 。
(5)若改用浓盐酸,则测出锌的厚度会 (填“偏大”、“偏小”、或“无影响”)。
(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢? 理由是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。实验室用粗铜(含少量铁)制备CuSO4·5H2O的流程如下:
回答下列问题:
(1)实验室配制250 mL4.8 mol·L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要__________________________________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图(已知气体X为电解饱和食盐水所得;母液苦卤中主要含有Ca2+、Mg2+,Cl-,SO42-、Br-等离子)请回答: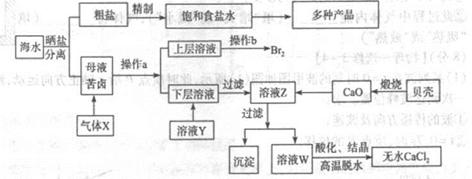
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:
| A.盐酸 | B.氯化钡溶液 | C.氢氧化钠溶液 | D.碳酸钠溶液,则加入试剂的顺序是(填编号)______ |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案设计中,可行的是( )
| A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 |
| B.用萃取的方法分离汽油和煤油 |
| C.用溶解、过滤的方法分离硝酸钾和氯化钠固体的混合物 |
| D.将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
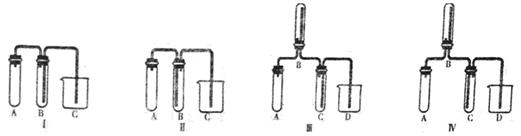
下列有关实验装置进行的相应实验,不能达到实验目的的是
| A.用装置①除去Cl2中含有的少量HCl |
| B.用装置②从KCl溶液中获得KCl晶体 |
| C.用装置③除去O2中混有的一定量SO2 |
| D.用装置④在实验室制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
海带中含碘元素。从海带中提取碘有如下步骤:①在滤液中通人足量Cl2;②将海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗加夜;⑤过滤。合理的操作顺序
| A.①②③④⑤ | B.②⑤①③④ | C.①③⑤②④ | D.②①③⑤④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com