
����Ŀ��X��Y��Z��W���ֻ��������ԭ������С��18��Ԫ����ɣ�����X��������Ԫ�أ�X��Y��Z����ɫ��Ӧ��Ϊ��ɫ��WΪ��ɫ��ζ���塣�����ֻ������������ת����ϵ(���ַ�Ӧ����P��Ӧ��������ȥ)����ش���
��1��W�Ļ�ѧʽ��______________��
��2��X��Y����Һ�з�Ӧ�����ӷ���ʽ��_________________________________��
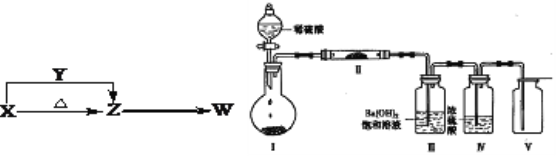
��3��ijʵ��С��������ͼװ��(�г̶ֹ�װ������ȥ)����ʵ�飬װ�â���ΪX��װ�â��в�����ɫ������װ��V�п��ռ���һ����ɫ���塣
��װ�â��з�Ӧ�Ļ�ѧ����ʽ��__________________________________��װ�â�����Ҫ�Ļ�ѧ��Ӧ����ʽ��__________________________________��
�ڢ��е��������������������Ӹ�������______��
���𰸡� CO2 HCO3-+OH-=H2O+CO32- 2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2�� 2Na2O2+2CO2=2Na2CO3+O2 2:1
��������X��Y��Z����ɫ��Ӧ��Ϊ��ɫ����X��Y��Z����NaԪ�أ�X��������Ԫ�أ��ڼ���������������Z����WΪ��ɫ��ζ�����壬X��Y��Z��W���ֻ��������ԭ������С��18��Ԫ����ɣ���XΪNaHCO3��YΪNaOH��ZΪNa2CO3��WΪCO2��
��1�����Ϸ�����֪��W�Ļ�ѧʽ��CO2��
��2��XΪNaHCO3��YΪNaOH�����߷�Ӧ����̼������ˮ�����ӷ���ʽΪ��HCO3-+OH-=CO32-+H2O��
��3����װ�â���ΪX(NaHCO3)����Һ©������ϡ���ᣬNaHCO3��H2SO4��Ӧ���������ơ�ˮ��CO2����Ӧ��ѧ����ʽΪ��2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2����װ�â��в�����ɫ������ӦΪװ�â��з�Ӧ���ɵ�CO2������װ�â��з�Ӧ��ʣ�࣬����װ�â�����������������Һ��Ӧ���ɵ�BaCO3��������Ϊװ�â�ʢ������������������Һ������CO2����ȫ���գ�װ��V���ռ�������ɫ����ӦΪװ�����еĹ�����CO2�ڳ����·�Ӧ���ɵģ���װ�â��й���ΪNa2O2��װ��V���ռ�������ɫ������O2��װ�â�����Ҫ�Ļ�ѧ��Ӧ����ʽ��2Na2O2+2CO2=2Na2CO3+O2���ڢ��е�����ΪNa2O2������Na+��O22-�����������������Ӹ�������2:1��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л����Ȼ�������̼���ƹ��壬Ϊ�ⶨ����̼���Ƶ�����������������·�����
��1����ȡ20.0g�������壬����ˮ�����Һ�����������CaCl2��Һ����Һ����ǣ�����ϴ�Ӹ���õ�����10g����̼���Ƶ�����������______________
��2����ȡ���������������壬������������ᣬ�����ɵ������ڱ�״���µ������__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ����Ͷ�뵽NaOH��Һ�У�2Al+2OH���T2AlO2��+3H2��
B. AlCl3��Һ�м��������İ�ˮ��Al3++ 3OH�� �TAl(OH)3��
C. ���Ȼ�����Һ�м������ۣ� ![]()
D. FeCl2��Һ��Cl2��Ӧ��2Fe2++Cl2�T2Fe3++2Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪ��������Ҫ�ɷ�ʾ��ͼ������˵����ȷ���ǣ� �� 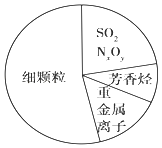
A.�����������ܲ������������
B.�ؽ������Ӷ������Σ����Ҫ����ɵ����ʵı���
C.SO2��NxOy����������������
D.��APEC������2014���µ�����ʻ㣬����2014��APEC�����ڼ䱱����������գ�˵������ʵʩ��·���к���Ⱦ��ҵͣ���ȴ�ʩ���ɶž������ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��д����������ӣ�Fe3+��SO42-��Al3+��M���ӣ�������������Fe3+��SO42-��Al3+��M�����ʵ���֮��Ϊ2��4��1��1����M���ӿ���Ϊ�����еģ� ��
A.Na+B.I-C.S2-D.Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B�����������Ǻ�̼����������ͬ�����й���A��B��������ȷ���ǣ� ��
A.A��Bһ����ͬ���칹��
B.A��B��������ͬϵ��
C.A��B���ʽһ����ͬ
D.A��B�Ļ�ѧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֶ���������Ԫ��aX��bY��cZ����֪a+c=2b����Z������������Ӧ��ˮ��������ѧ������ǿ�ᣬ�������й�˵������ȷ���ǣ� ��
A.��XΪO����Y��X�γɵij���������һ�������ӻ�����
B.��X��Na����Z���������һ����ż��
C.��YΪO����ǽ����ԣ�X��Y��Z
D.��YΪNa����X��Z��������ͬһ����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ơ��صĵ⻯���������Ϳ�ѧʵ������ʮ����Ҫ��Ӧ�ã���ҵ���õ⡢NaOH����мΪԭ�Ͽ������⻯�ƣ�������������ͼ1�� 
��1��NaOH��Һ�͵ⷴӦʱ��Ҫ�ϸ�����¶ȣ�����¶ȹ��ͣ������ɵ�ĵͼ۸���ƷNaIO����NaOH��Һ�͵ⷴӦʱ������Һ��IO3����IO�������ʵ���֮��Ϊ1��1����÷�Ӧ�����ӷ���ʽΪ ��
��2�����������м��������м��Ŀ���� �� �������ù����г�ʣ����м�⣬���к��ɫ���壬�������мʱ������Ӧ�Ļ�ѧ����ʽ�� ��
��3����Һ2�г�����H+�⣬һ�����е����������������ʵ��֤ʵ�ý��������ӵĴ��� ��
��4����Һ2��һϵ��ת�����Եõ������������壨FeC2O42H2O������ȡ3.60g�����������壨��Է���������180�������ط���������ȷֽ⣬�õ�ʣ�������������¶ȱ仯��������ͼ2��ʾ������ͼ�����ݣ�������Ϣд�����̢���2�Ļ�ѧ����ʽ ��
��300��ʱʣ�����ֻ��һ�����������������ͨ������ȷ����������Ļ�ѧʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com