

分析 (1)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关;
由相同浓度亚硝酸、次氯酸电离常数可知,亚硝酸酸性比次氯酸强,根据强酸制备弱酸书写离子方程式;
(2)根据氨水呈弱碱性的原理分析羟胺呈弱碱性的原因;
(3)红棕色刺激性气味气体为NO2,无色刺激性气味气体为NO,据此书写离子反应液方程式即可;
(4)①依据发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,判断CO的作用;
②依据氧化还原反应中铜元素、磷元素化合价变化计算;
(5)根据Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)计算;
(6)电解过程中生成n(NaOH)=0.3mol/L×0.5L=0.15mol,设生成0.15molNaOH转移电子的物质的量为x,据此解答即可.
解答 解:(1)亚硝酸为弱电解质,亚硝酸稀释,电离程度虽然增大,但溶液中氢离子浓度降低;其电离常数只与温度有关,与浓度无关,Ki值不发生变化,由相同浓度亚硝酸、次氯酸电离常数可知,亚硫酸酸性比次氯酸强,可能相互之间发生的离子互换反应的离子方程式为:HNO2+ClO-=NO2-+HClO,
故答案为:减小;不变;HNO2+ClO-=NO2-+HClO;
(2)羟胺和水反应生成[NH3OH]+和OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,故答案为:NH2OH+H2O?[NH3OH]++OH-;
(3)红棕色刺激性气味气体为NO2,无色刺激性气味气体为NO,离子反应方程式为:2NO2-+2CH3COOH═NO2+NO+2CH3COO-+H2O,
故答案为:2NO2-+2CH3COOH═NO2+NO+2CH3COO-+H2O;
(4)①步骤Ⅰ为白磷的工业生产方法之一,发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,反应中C中的碳化合价升高,做还原剂,
故答案为:做还原剂;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为n则:n×4(5-0)=1mol×(2-1),解得n=$\frac{1}{20}$mol=0.05mol,故答案为:0.05mol;
(5)若处理后的废水中c(PO43-)=4×10-7 mol•L-1,Ksp[Ca3(PO4)2]=[c(Ca2+)]3×c(PO43-)=2×10-29,c(Ca2+)=$\root{3}{\frac{2×1{0}^{-29}}{(4×1{0}^{-7})^{2}}}$=5×10-6mol•L-1,故答案为:5×10-6;
(6)电解过程中生成n(NaOH)=0.3mol/L×0.5L=0.15mol,设生成0.15molNaOH转移电子的物质的量为x,
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ 转移电子
2mol 2mol
0.15mol x
2mol:2mol=0.15mol:x,
x=0.15mol,串联电路中转移电子物质的量相等,且液氨-液氧燃料电池的效率为50%,则液氨失电子的物质的量为0.3mol,
设消耗氨气的质量为y,
4NH3+3O2=2N2+6H2O 转移电子
68g 12mol
y 0.3mol
68g:12mol=y:0.3mol,y=1.7g,故答案为:1.7g.
点评 本题综合考查的是难溶电解质的平衡、化学电源新型电池,以此为载体考查电池反应式的书写、方程式的有关计算,侧重考查分析、计算能力,明确串联电路中转移电子关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol甲苯含C-H键的数目为6NA | |
| B. | 反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中生成28gN2时,转移电子数目为15NA | |
| C. | 1molFeCl3与水反应完全转化为氢氧化铁胶体后,胶体粒子的数目为NA | |
| D. | 含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
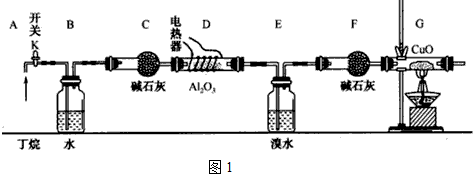
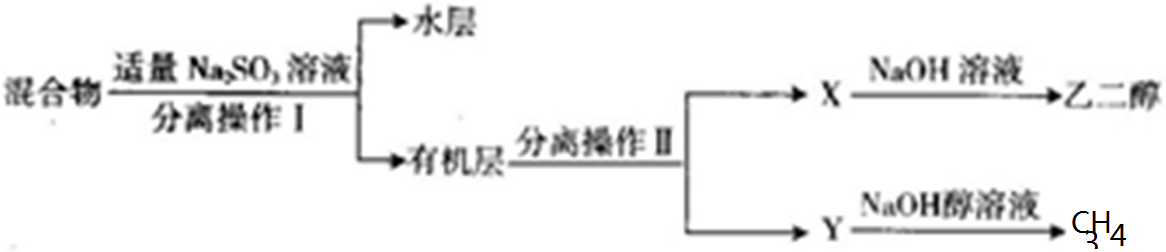
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性 | |
| B. | 如图可表示常温下,稀释HA、HB两种酸的稀溶液时溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 | |
| C. | 25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA | |
| D. | 某吸热反应能自发进行,则该反应一定是熵增的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 放电时,电极A为负极 | |
| B. | 该电池工作的适宜温度应控制10℃左右 | |
| C. | 放电时,内电路中Na+的移动方向为A到B | |
| D. | 充电时,阳极的电极反应式为 Sx2--2e-═xS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
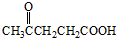 )合成聚芳酯E的路线:
)合成聚芳酯E的路线:
 +SOCl2→
+SOCl2→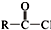 +SO2+HCl
+SO2+HCl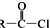 +R′OH→
+R′OH→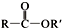 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基) .
. .
.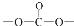 结构;
结构; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 | |
| B. | 氯气可置换出KEr溶液中的溴,则氟气也可置换出KBr中的溴 | |
| C. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-14+dmon•L-1 | |
| D. | 某温度下,MgCO3的Ksp=6.8×10-6,则该温度下所有含固体MgCO3的溶液,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.8×10-6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com