
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是___________,违反了洪特规则的是____________。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
(2)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na____Mg,Mg_____Ca。
②电负性:O______F,F______Cl。
③能量高低:ns______(n+1)s,ns______np。
④主族序数______价电子数______元素最高正化合价。
【答案】② ③⑤ < > < > < < = =
【解析】
(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则;
(2)①同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素,同一主族元素中,元素的第一电离能随着原子序数的增大而减小;
②同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小;
③电子的能层越大其能量越高,同一能层的电子,按s、p、d、能量逐渐增大;
④主族序数等于价电子数等于元素最高正化合价。
(1)同一个原子轨道中不应有自旋状态相同的电子,②违反了泡利原理;对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋状态相同,③⑤违反了洪特规则,故答案为:②;③⑤;
(2)①同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素,同一主族元素中,元素的第一电离能随着原子序数的增大而减小,所以第一电离能:Na<Mg,Mg>Ca,故答案为:<;>;
②同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,所以电负性:O<F,F>Cl,故答案为:<;>;
③电子的能层越大其能量越高,同一能层的电子,按s、p、d、能量逐渐增大,所以能量高低:ns<(n+1)s,ns<np,故答案为:<;<;
④主族序数等于价电子数等于元素最高正化合价,故答案为:=;=。


科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
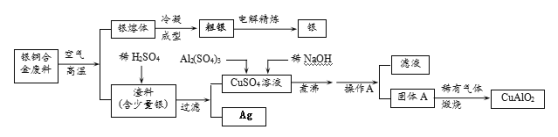
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物B,俗名水杨酸,其结构简式为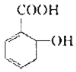 ,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_____,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_____(填写除了羟基以外的官能团名称)。
,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_____,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_____(填写除了羟基以外的官能团名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)![]() pQ (g)+2mZ(g),达到平衡时c( X) =0.3 mol L-1。其他条件不变,将容器体积缩小到原来的
pQ (g)+2mZ(g),达到平衡时c( X) =0.3 mol L-1。其他条件不变,将容器体积缩小到原来的![]() ,重新平衡后c(X) =0.5 mol L-1。下列说法正确的是
,重新平衡后c(X) =0.5 mol L-1。下列说法正确的是
A.平衡逆方向移动B.Y 可能是固体
C.系数n>mD.Z 的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.治疗胃酸过多的药物达喜(其式量不超过 700)由五种短周期元素组成,按如下流程进行实验以确定其组成。
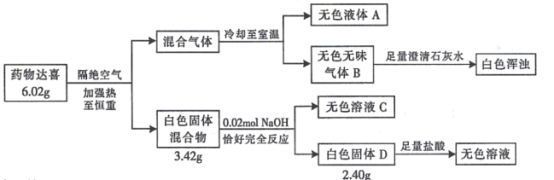
请回答:
(1)达喜的化学式是_____________。
(2)达喜与胃酸(含稀盐酸)反应的化学方程式是____________。
(3)气体 B 与环氧丙烷(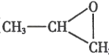 )可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
)可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
II.将 NaC1O3 溶液逐滴加入到碘单质和过量盐酸的混合液中可制备液态 ICl,实验装置如下图:
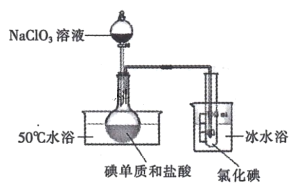
请回答:
(1)圆底烧瓶中发生的化学反应是______________( 用化学方程式表示)。
(2)若加入的 NaClO3 溶液已足量,请设计实验方案证明该反应已完全:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以异丙苯为起始原料,按下列路线合成植物香料花青醛。

已知:(l)RX![]() RMgX
RMgX ( R 表示烃基);
( R 表示烃基);
(2)RCHO + R'CH2CHO (R、R' 表示烃基或氢原子)。
(R、R' 表示烃基或氢原子)。
请回答:
(1)下列说法正确的是__________(填序号)。
A.异丙苯到化合物C 共经历了三步取代反应
B.常温常压下,化合物D可溶于NaOH 溶液
C.化合物B具有弱碱性
D.花青醛的分子式是C13H18O
(2)写出化合物E的结构简式___________。
(3)写出反应①的化学方程式___________。
(4)设计从乙烯到F 的合成路线(用流程图表示,无机试剂任选)_______。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式______。1H-NMR谱和IR谱检测表明:
①分子中共有4种氢原子,有氮氢键;
②除苯环外不含其它环状结构,且无氮氧键、碳氮双键和氧氢键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
①已知KBrO3在反应中得到电子,则该反应的还原剂是____________________
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_____________
③根据上述反应可推知_______
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3
c.还原性:AsH3>X d.还原性:X > AsH3
(2)①向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+,该反应常用于检验Mn2+的存在。其特征现象是_________________,若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为__________
②将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+MnSO4+H2SO4→Na2SO4+Bi2(SO4)3+NaMnO4+H2O,配平上述反应的化学方程式,并用双线桥标出电子转移的方向和数目__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。下列说法不正确的是
A.H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-
B.加入NaOH溶液使溶液呈碱性,可以将Cr2O72-转化为CrO42-
C.加入H2O2的离子方程式2Cr3++3H2O2+H2O=Cr2O72-+8H+
D.钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有Al3+、Ca2+和Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
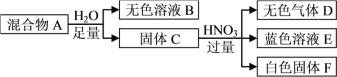
下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com