
 2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为
2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为 A.1
B.2
C.3
D.4
科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
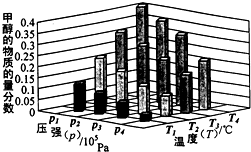 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源:2011届浙江省杭州高级中学高三高考全真模拟卷(理综)化学试题 题型:填空题
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式:______________________。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式:
__________________________________________________________________________。
(3)在T1℃时,将5 mol N2O5置于10 L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①上述平衡体系中O2的体积分数为__________,N2O5的物质的量为__________mol。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= __________。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有__________。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大
C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
查看答案和解析>>
科目:高中化学 来源:2014届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:填空题
氮是大气中含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用,减少氮氧化物的排放是环境保护的重要内容之一。请回答下列氮及其化合物的相关问题:
(1)据报道,意大利科学家获得了极具研究价值的N4,其分子结构与白磷分子的正四面体结构相似。已知断裂1 mol N-N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,请写出N4气体转变为N2反应的热化学方程式: 。
(2)据报道,NH3可直接用作车用燃料电池,写出该电池的负极反应式: 。
(3)在T1℃时,将5 mol N2O5置于10L固定容积的密闭容器中发生下列反应:2N2O5(g) 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
①求该反应的平衡常数K= (数字代入式子即可),上述平衡体系中O2的体积分数为__________。
②用O2表示从0~5 min内该反应的平均速率υ(O2)= 。
③将上述平衡体系的温度降至T2℃,密闭容器内减小的物理量有 。
A.压强 B.密度 C.反应速率 D.N2O5的浓度
(4)在恒温恒容的密闭容器中充入NO2,建立如下平衡:2NO2(g) N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
N2O4(g),平衡时N2O4与NO2的物质的量之比为a,其它条件不变的情况下,分别再充入NO2和再充入N2O4,平衡后引起的变化正确的是__________。
A.都引起a减小 B.都引起a增大 C.充入NO2引起a减小,充入N2O4引起a增大
D.充入NO2引起a增大,充入N2O4引起a减小
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:
2SO2+O2 ![]() 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容
器中放入起始物质,平衡时SO3的物质的量可能大于n的是 ( )
A.2 mol SO2 + 1 mol O2 B.4 mol SO2 + 1 mol O2
C.2 mol SO2 + 1 mol O2 + 2 SO3 D.3 mol SO2 + 1 SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com