
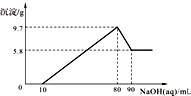
 将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.
将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.| 5.8g |
| 58g/mol |
| n |
| V |
| 5.8g |
| 58g/mol |
| 0.4mol |
| 0.1L |


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
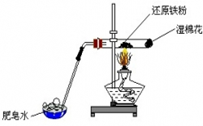
| A、实验时,试管口应高于试管底 | ||||
| B、加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声 | ||||
C、反应的化学方程式为:2Fe+3H2O(g)
| ||||
| D、用盐酸溶解反应后的固体,向所得溶液中滴入KSCN溶液,未显红色,说明原反应未能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该安装方式的水表更容易被腐蚀 |
| B、发生腐蚀过程中,电子从接头流向水表 |
| C、腐蚀时水表发生的电极反应为:2H2O+O2+4e-=4OH- |
| D、腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将水倒入浓硫酸中配制稀硫酸 |
| B、金属钠着火,立即用泡沫灭火器灭火 |
| C、炒菜时,油锅着火,应立即用锅盖盖灭 |
| D、用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙炔的键角为180°,是非极性分子 | ||
| B、碳原子sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且互相垂直 | ||
C、碳碳三键中三条键能量大小相同,其键长是碳碳单键的
| ||
| D、乙炔分子中既有极性键也有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、试管a中产生白烟 |
| B、试管b中溶液由红色变为蓝色 |
| C、试管c中能发生氧化还原反应 |
| D、试管d中先有沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有③④ |
| C、只有①③④ | D、全部都是 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com