
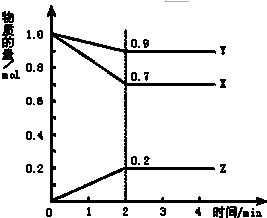
 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:分析 (1)根据v=$\frac{△c}{△t}$进行计算XYZ的反应速率,;
(2)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式.
解答 解:(1)反应开始至2min末,Z的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),v(X)=$\frac{\frac{1.0mol-0.7mol}{2L}}{2min}$=0.075mol/L•min,v(Y)=$\frac{\frac{1.0mol-0.9mol}{2L}}{2min}$=0.025mol/L•min,
故答案为:0.05mol/(L•min);0.025mol/L•min;0.075mol/L•min;
(2)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,
当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,
则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z.
点评 本题考查化学反应速率图象题目,题目难度不大.把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 验证化学能转化为电能 | 验证非金属性:Cl>C>Si | 实验室制氨气 | 研究催化剂对化学反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n}{16+A}$(A-N+8)mol | B. | $\frac{n}{16+A}$(A-N+10)mol | C. | (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
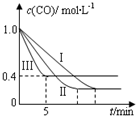 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,用电子式表示X与R化合物的形成过程
,用电子式表示X与R化合物的形成过程
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com