
【题目】请根据要求回答下列问题:
(1)49g H2SO4含______个 H2SO4分子,与______mol NaOH恰好完全中和。
(2)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量比是_______,CO的体积分数是______,C和O的原子个数比是_____,混合气体的平均摩尔质量是________。
(3)等质量的O2和O3所含分子数之比为______,所含原子数之比为________。
(4)某气态氧化物的化学式为 RO2,在标准状况下,1.28g 该氧化物的体积为448mL,则该氧化物的摩尔质量为______, R 的相对原子质量为______。
(5)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体,该混合气体是氢气密度的_________倍。
(6)将4g NaOH固体溶于水配成500mL 溶液。 若从中取出10mL,加水稀释到50mL,则稀释后NaOH 溶液的物质的量浓度为_______mol/L。
【答案】 3.01×1023(或0.5NA) 1 1:3 25% 4:7 40g/mol 3∶2 1∶1 64 g·mol-1 32 8.4 0.04
【解析】(1)49gH2SO4的物质的量是49g÷98g/mol=0.5mol,含0.5NA个H2SO4分子,根据H2SO4+2NaOH=Na2SO4+2H2O,因此与1molNaOH恰好完全中和。(2)混合气体的物质的量是8.96L÷22.4L/mol=0.4mol,设CO和CO2的物质的量分别是xmol、ymol,则x+y=0.4、28x+44y=16,解得x=0.1、y=0.3,因此混合物中CO和CO2的物质的量比是1:3,CO的体积分数是![]() ;C和O的原子个数比是(0.1+0.3):(0.1+0.3×2)=4:7,混合气体的平均摩尔质量是16g÷0.4mol=40g/mol;(3)等质量的O2和O3所含分子数之比为
;C和O的原子个数比是(0.1+0.3):(0.1+0.3×2)=4:7,混合气体的平均摩尔质量是16g÷0.4mol=40g/mol;(3)等质量的O2和O3所含分子数之比为![]() 3:2,所含原子数之比为3×2:2×3=1:1。(4)该气体的物质的量是0.448L÷22.4L/mol=0.02mol,所以该氧化物的摩尔质量为1.28g÷0.02mol=64g/mol,R的相对原子质量为64-16×2=32;(5)该混合气体的平均相对分子质量是0.75×22.4=16.8,所以根据密度之比是相对分子质量之比可知是氢气密度的16.8÷2=8.4倍。(6)氢氧化钠的物质的量是4g÷40g/mol=0.1mol,氢氧化钠的浓度是0.1mol÷0.5L=0.2mol/L。根据稀释过程中溶质的物质的量不变可知稀释后NaOH溶液的物质的量浓度为
3:2,所含原子数之比为3×2:2×3=1:1。(4)该气体的物质的量是0.448L÷22.4L/mol=0.02mol,所以该氧化物的摩尔质量为1.28g÷0.02mol=64g/mol,R的相对原子质量为64-16×2=32;(5)该混合气体的平均相对分子质量是0.75×22.4=16.8,所以根据密度之比是相对分子质量之比可知是氢气密度的16.8÷2=8.4倍。(6)氢氧化钠的物质的量是4g÷40g/mol=0.1mol,氢氧化钠的浓度是0.1mol÷0.5L=0.2mol/L。根据稀释过程中溶质的物质的量不变可知稀释后NaOH溶液的物质的量浓度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,在体积为10mL、物质的量浓度为0.1mol/L的某酸HA溶液中逐滴滴入物质的量浓度为0.lmol/L的NaOH溶液,测得混合溶液的pH随NaOH溶液体积的变化如图所示(忽略混合后溶液体积的变化)。请回答以下问题:
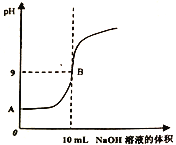
(1)HA为___________(填“强酸”或“弱酸”),做出该判断的理由是____________________。
(2)常温下,0.1mol/L NaOH溶液中由水电离出的c(OH-)=__________mol/L;B点时,溶液中由水电离出的c(OH-)=__________mol/L。
(3)B点时,混合溶液中各离子浓度的大小关系为________________________,c(HA)+ c(A-)=__________mol/L。
(4)若测得NH4A溶液的pH=7,且将HA溶液滴入(NH4)2CO3溶液中有CO2生成,则相同条件下,的物质的量浓度下列溶液的pH由小到大的顺序为___________________。
a.NH4A b.NH4Cl
c.NH4HCO3 d.(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是( )
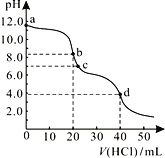
A. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
B. a点溶液呈碱性的原因用离子方程式表示为: CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. b点溶液中c(Na+)> c(HCO![]() )> c(Cl-)
)> c(Cl-)
D. d点处溶液中水的电离程度大于b点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂,将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四瓶溶液区分开,这种试剂是( )
A. NaOH溶液 B. AgNO3溶液
C. BaCl2溶液 D. Ba(OH)2浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
(2)根据等电子原理,写出CO分子的结构式 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O 沉淀。
①甲醇的沸点比甲醛的高,其主要原因是 ;
甲醛分子中碳原子轨道的杂化类型为 。
②甲醛分子的空间构型是 ;
1mol甲醛分子中σ键的数目为 。
③在1个Cu2O 晶胞中(结构如图所示),

所包含的Cu 原子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2min 后,测得参加反应的X2为0.6mol/L,用Y2的变化表示的反应速率v(Y2) =0.1mol/(L·min),生成的c(Z)为0.4mol/L,则该反应的化学方程式是
A. X2+2Y2 ![]() 2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2![]() 2X2Y
2X2Y
C. 3X2+Y2![]() 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m g钠和铝的混合物放入n g足量水中,待反应停止后,得到a g沉淀,则滤液中的溶质是( )
A. NaAlO2 B. NaAlO2和NaOH C. Al(OH)3 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g) +H2(g)![]() CO (g) +H2O (g)
CO (g) +H2O (g)
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________。
(2)能说明该反应达到化学平衡状态的是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______℃。
(4) 830℃时,在1L密闭容器中分别投入lmolH2和lmolCO2反应达到化学平衡时,CO2的转化率为__________;保持温度不变,在平衡体系中再充入1molH2和lmolCO2重新达到化学平衡时,CO2的平衡转化率_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com