
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 分子式为C10H14且只有一个侧链的芳香烃,不饱和度为$\frac{2×10+2-14}{2}$=4,分子中含有一个苯环,则侧链是烷基,为-C4H9,书写-C4H9的异构体,确定符合条件的同分异构体数目.
解答 解:分子式为C10H14且只有一个侧链的芳香烃,不饱和度为$\frac{2×10+2-14}{2}$=4,分子中含有一个苯环,则侧链是烷基,为-C4H9,-C4H9的异构体有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,故符合条件的结构有4种.
故选C.
点评 本题考查同分异构体的书写,注意取代基异构的书写是解题的关键,难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 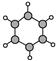 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 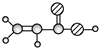 |
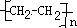 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 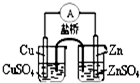 能组成Zn、Cu原电池 | B. |  能证明非金属性C>Si | ||
| C. | 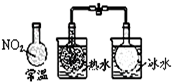 说明反应2NO2?N2O4△H>0 | D. | 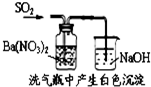 白色沉淀为BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与126C互为同位素 | B. | 表示碳元素的一种核素 | ||
| C. | 质量数是13,核内有6个中子 | D. | 原子序数是6,核内有7个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com