
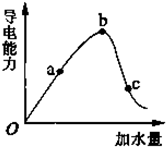
 一定温度下,冰醋酸和水稀释过程中溶液的导电能力曲线如图所示,请回答:
一定温度下,冰醋酸和水稀释过程中溶液的导电能力曲线如图所示,请回答:

科目:高中化学 来源: 题型:
| 物质 | 需加入的药品 | 离子方程式 |
| CaCl2( CaCO3) | ||
| FeSO4 (CuSO4) | ||
| Cu(Al) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| Q | Q的气态氢化物是一种10电子微粒,呈现碱性 |
| R | R是地壳中含量最丰富的元素 |
| X | X与Y在同一周期,X是这一周期中原子半径最大的元素 |
| Y | Y的次外层电子数是最外层电子数的两倍 |
| Z | Z是一种副族的金属元素,原子序数为26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用大理石跟稀盐酸制二氧化碳:CO32-+2H+═H2O+CO2↑ |
| B、向氢氧化钡溶液中加硫酸溶液:SO42-+Ba2+=BaSO4↓ |
| C、硫酸溶液中加入Mg(OH)2:2H++Mg(OH)2═Mg2++2H2O |
| D、铁与稀盐酸反应:Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com