
 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液可能显中性或酸性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
分析 0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,HCl+BOH=BCl+H2O,所得溶液中B+浓度小于0.1mol/L,说明在溶液中存在B++H2O?H++BOH,B0H为弱碱,BCl溶液呈酸性,则c(OH-)<c(H+),一般来说,盐类的水解程度较低,则有c(B+)>c(H+),所以有:c(Cl-)=0.1mol/L>c(B+)>c(H+)>c(BOH)>c(OH-)即X表示H+,Y表示BOH,Z表示OH-,溶液中存在物料守恒为:c(Cl-)=c(B+)+c(BOH).据此分析.
解答 解:0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,HCl+BOH=BCl+H2O,所得溶液中B+浓度小于0.1mol/L,说明在溶液中存在B++H2O?H++BOH,B0H为弱碱,BCl溶液呈酸性,则c(OH-)<c(H+),一般来说,盐类的水解程度较低,则有c(B+)>c(H+),所以有:c(Cl-)=0.1mol/L>c(B+)>c(H+)>c(BOH)>c(OH-)即X表示H+,Y表示BOH,Z表示OH-,溶液中存在物料守恒为:c(Cl-)=c(B+)+c(BOH).
A.BOH为弱碱,BCl溶液显酸性,故A错误;
B.升温促进水解Y浓度增大,故B错误;
C.X表示H+,Y表示BOH,Z表示OH-,溶液中存在物料守恒为:c(Cl-)=c(B+)+c(BOH),故C正确;
D.稀释溶液促进水解,离子浓度减小,则c(OH-)减小,故D错误;
故选C.
点评 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、溶液PH值、盐类水解等,判断一元碱BOH是弱碱为解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
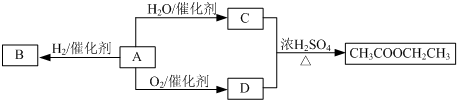
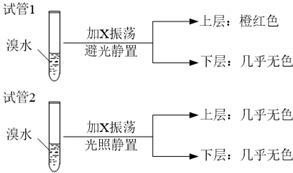
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
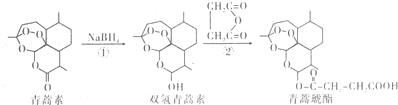
| A. | 青蒿素分子中所有碳原子在同一平面内 | |
| B. | 反应①属于还原反应,反应②理论上原子利用率可达100% | |
| C. | 双氢青蒿素属于芳香化合物 | |
| D. | 青蒿琥酯可以发生水解、酯化以及加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化时,c(I-):c(Br-)=1:1 | |
| D. | 当0.2<a<0.3时,溶液中各离子浓度的关系为2c(Fe2+)+3c(Fe3+)+c(H+)═c(Br-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
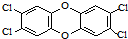 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是| A. | 它能发生还原反应 | B. | 它能燃烧 | ||
| C. | 它的一溴取代物只有一种 | D. | 此分子中共平面的原子最多有18个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
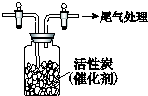 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
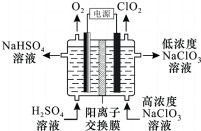 ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )
ClO2是高效杀菌消毒剂.用惰性电极电解NaC1O3溶液制备高纯C1O2的原理如下图所示.下列说法正确的是( )| A. | 电解过程中,Na+向阴极区移动 | |
| B. | 电解产生的O2和ClO2在相同条件下的体积比为1:1 | |
| C. | 阴极的电极反应式是ClO3-+H2O+e-=ClO2↑+2OH- | |
| D. | 电解总反应的化学方程式是4NaClO3+4H2SO4$\frac{\underline{\;电解\;}}{\;}$O2↑+4ClO2↑+4NaHSO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z>W;氢化物的沸点是Z<W | |
| D. | 还原性Zm->W(m+1)-,氧化性Xn+>Y(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
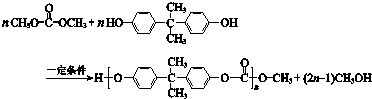
| A. | PC含有酯基 | |
| B. | 合成PC的反应为缩聚反应 | |
| C. | 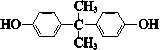 与 与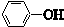 互为同系物 互为同系物 | |
| D. | 1 mol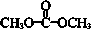 最多能与2 mol NaOH完全反应 最多能与2 mol NaOH完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com