
 =0.5mol,所以1mol氢气完全燃烧生成液态水放出的热量为143kJ×
=0.5mol,所以1mol氢气完全燃烧生成液态水放出的热量为143kJ× =286kJ,所以H2燃烧热的热化学方程式为:H2(g)+
=286kJ,所以H2燃烧热的热化学方程式为:H2(g)+ O2(g)=H2O(l)△H=-286kJ?mol-1;
O2(g)=H2O(l)△H=-286kJ?mol-1; O2(g)=H2O(l)△H=-286kJ?mol-1;
O2(g)=H2O(l)△H=-286kJ?mol-1;

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:阅读理解
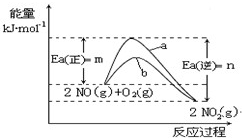
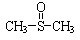 ),有关反应如下:
),有关反应如下:| c2(NO2) |
| C2(NO)c(O2) |
| c2(NO2) |
| C2(NO)c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)C、Si、S和N元素在化学中占有极其重要的地位。
(1)写出Si的基态原子价电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(4)SO2、NO2、H2S同属于 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2012届陕西省西工大附中高三第11次模拟考试理综化学试卷(带解析) 题型:填空题
(15分)C、Si、S和N元素在化学中占有极其重要的地位。 (1)写出Si的基态原子价电子排布式 。
(1)写出Si的基态原子价电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。 (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。 (4)SO2、NO2、H2S同属于 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是 。
(4)SO2、NO2、H2S同属于 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省高三第11次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)C、Si、S和N元素在化学中占有极其重要的地位。
 (1)写出Si的基态原子价电子排布式
。
(1)写出Si的基态原子价电子排布式
。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
 (4)SO2、NO2、H2S同属于
结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是
。
(4)SO2、NO2、H2S同属于
结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com