
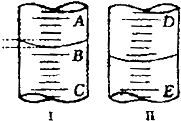
 (如图)(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是
(如图)(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、标准状况下NA个SO3的体积为22.4 L |
| B、1mol Fe与足量的HCl反应,转移的电子数为3NA |
| C、2L 1mol/L的 H3PO4溶液中所含的H+数为6NA |
| D、标准状况下22.4L Cl2通入足量的石灰乳制备漂白粉,转移电子数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
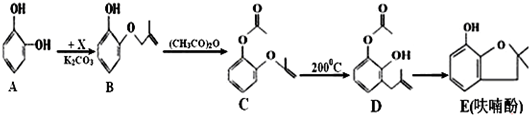
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2010年11月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| B、小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 |
| D、从海水中制取氯气的过程涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C4H10(g)+
| ||
B、C4H10(g)+
| ||
C、C4H10(g)+
| ||
D、C4H10(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成水的氢气和氧气都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢能成为二级能源 |
| B、设法将太阳光聚焦,产生高温,使水分解产生氢气 |
| C、寻找特殊化学物质,使水分解产生氢气,同时释放能量 |
| D、寻找特殊化学物质,用于开发廉价能源以分解水制取氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com