
如图,下列装置属于原电池的是 ()
A. 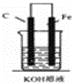 B.
B.  C.
C. 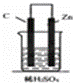 D.
D. 
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
实验室中所用氯气是用如下方法制取的4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O.试回答下列问题:
Cl2↑+MnCl2+2H2O.试回答下列问题:
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂, 是氧化产物, 是还原产物.若标况下生成33.6L Cl2,则该反应中转移 mol电子.
(2)HCl在该反应中的作用为:
(3)氯气溶入水显酸性,写出该反应的离子方程式:Cl2+H2O=H++Cl﹣+HClO;氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境.实验室中可采用NaOH溶液来吸收有毒的氯气,相关的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2 10L;b.O2 20L;c.N2 40L;d.CH460L.则4个容器中气体的质量由大到小的顺序是()
A. a>b>c>d B. b>a>d>c C. c>d>b>a D. d>c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
用一定体积的浓度为18mol•L﹣1浓硫酸配制100mL3.0mol•L﹣1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解④转移、洗涤 ⑤定容 ⑥摇匀
按要求回答下列问题:
(1)所需浓硫酸的体积是 取浓硫酸所用的量筒的规格是B.
从下列选项中选择:A.10mL B.25mL C.50mL D.100mL.
(2)对所配制的稀硫酸进行测定,发现其浓度大于3mol/L,配制过程中下列各项操作可能引起该误差的原因有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(3)将正确配制的上述溶液取出10mL,将此10mL溶液稀释至1L,则硫酸电离出的H+物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2﹣具有相同的电子层结构,W与X同主族,下列说法正确的是()
A. 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. Y分别与Z、W形成的化合物中化学键类型相同
C. X的最高氧化物对应的水化物的酸性比W的弱
D. Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
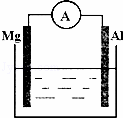
如图所示装置:
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 式为:正极 .该装置将化学能转化为
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或数据合理的是()
A. 用过滤的方法分离Fe(OH)3胶体和HCl溶液
B. 用托盘天平称取25.12gNaCl固体
C. 分别含有Mg2+、Cu2+和Na+的三种盐溶液,用NaOH溶液就能一次鉴别开
D. 从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1molNa2SO4溶于水能电离出 个Na+、 个SO42﹣.
(2) molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等.
(3)标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数为 .该混合气体对氢气的相对密度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是()
A. Cl﹣的结构示意图: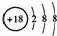
B. 质子数为53,中子数为78的碘原子: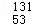 I
I
C. 光导纤维主要成分的化学式:Si
D. H216O、D216O、H218O、D218O互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com