
| A、AgNO3溶液和NaCl溶液 |
| B、BaCl2溶液和KHSO4溶液 |
| C、NaHCO3溶液和盐酸 |
| D、Na2CO3溶液和盐酸 |


科目:高中化学 来源: 题型:
 某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:
某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:| 实验 编号 | 温度/K | 盐酸浓度 /mol?L-1 | 醋酸浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 0.20 | |||
| ⑤ | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40 | B、42 | C、44 | D、46 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6mol C+2mol D |
| B、1mol A+0.5mol B+1.5mol C+0.5mol D |
| C、1mol A+0.5mol B+1.5mol C |
| D、4mol A+2mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |  | 白色结晶粉末 | 170~172℃ | 易溶于水 |

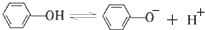 ,苯酚的酸性大于
,苯酚的酸性大于 (邻羟基苯甲醛),其原因是
(邻羟基苯甲醛),其原因是查看答案和解析>>
科目:高中化学 来源: 题型:
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、原混合酸中HNO3的物质的量为0.1 mol |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、H2SO4浓度为2.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题:
1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com