
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Ca2+、Na+、Cl-、HCO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.水电离出的c(H+)=10-13mol·L-l的溶液中:K+、Na+、SO42-、ClO-
D.有较多Fe3+的溶液中:Na+、NH4+、S CN-、HCO3-
CN-、HCO3-
 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源:2016-2017学年安徽省高二上期中文化学卷(解析版) 题型:选择题
NO对于心脑血管系统功能的改善具有重要作用。下列关于NO的描述不正确的是( )
A.难溶于水 B.可由氮气和氧气在放电条件下反应生成
C.常温下能与氧气化合 D.红棕色气体
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:选择题
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:实验题
高氯酸铵可用于火箭推进剂,实验室可由NaClO等原料制取(部分物质溶解度如下图),其实验流程如下:
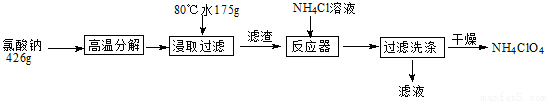
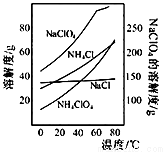
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为_____________________。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为_________________(写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为_____________________
(4)已知:2NH4C1O4 N2+2O2↑+C12↑+4H2O,现可提供下列试剂:
N2+2O2↑+C12↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.CuO e.Cu
利用下图装置对高氯酸 铵热分解产生的三种气体进行分别吸收或收集。
铵热分解产生的三种气体进行分别吸收或收集。

①E中收集到的气体可能是__________(填化学式)。
②A、B、C中盛放的药品依次可以是_________(选填:I、II、III)。
I.a、b、d II.c、b、d III.c、b、e
(5)过滤用到的主要玻璃仪器是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:选择题
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物己略去),则W、X不可能是( )
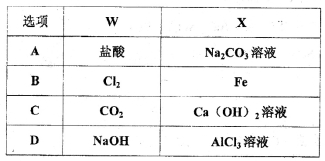
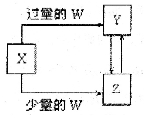
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
室温下,用0.1 mol/L HCl溶液滴定10 mL 0.1 mol/L Na2CO3溶液,滴定曲线如图所示。下列说法正确的是
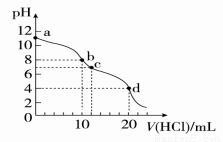
A.a点时:c(Na+)>c(CO32-)>c (HCO3-)>c(OH-)
B.b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.水电离程度由大到小的顺序为:a>b>c>d
D.d点时:c(H+)>c(HCO3-)=c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:实验题
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为 合成氨的原料。完成下列填空:
合成氨的原料。完成下列填空:
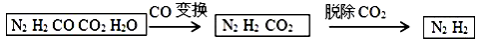
(1)半水煤气含有少量硫化氢。将半水煤气样品通入 溶液中(填写试剂名称),出现 ,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式 ;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中: V(H2): V(N2)=__________。
V(H2): V(N2)=__________。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠洛液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c mol.L-1的标准盐酸溶液VlmL,此时再向溶液中滴入1-2滴__________做指示剂,达到滴定终点时又用去V2mL标准盐酸溶液。
第二次滴定达到终点时的现象是______________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则____________(填化学式)浓度偏大。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:实验题
某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体___________g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
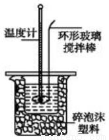
取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
(1)写出该反应的热化学方程式为___________(中和热为57.3kJ/mol);
(2)①请填写下表中的空白:
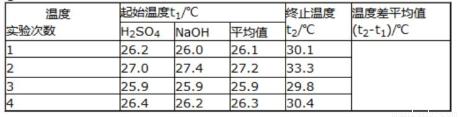
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃)。则中和热△H=___________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___________(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com