
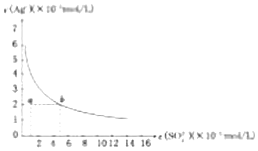
| A�� | ��SO42-Ũ��Ϊ3mol/L����Һ�п϶�������Ag+ | |
| B�� | 0.02mol/L��AgNO3��Һ��0.2mol/L��Na2SO4��Һ�������ϲ������ɳ��� | |
| C�� | ���κδ���Ag2SO4�������ܶȻ���c��Ag+��=2c��SO42-�� | |
| D�� | a���ʾAg2SO4�IJ�������Һ����������ʹ��Һ��a��䵽b�� |
���� A�����ܵ���ʴ����ܽ�ƽ�⣻
B��Ksp=c2��Ag+��c��SO42-����Qc��Kspʱ���ɳ�����Qc��Kspʱ�������ɣ�
C������Ag2SO4��s��?2Ag+��aq��+SO42-��ag���������ӡ���������Ӿ�Ӱ��ƽ���ƶ���
D�������ϵĵ�Ϊƽ��㣬����ʱc��Ag+����c��SO42-��������
��� �⣺A�����ܵ���ʴ����ܽ�ƽ�⣬��SO42-Ũ��Ϊ3mol/L����Һ�п϶�����������Ag+����A����
B����������ʱQc=��10-2��2��0.1=10-5��Ksp=��0.02��2��0.05=2��10-5���������ɳ�������B��ȷ��
C������Ag2SO4��s��?2Ag+��aq��+SO42-��ag���������ӡ���������Ӿ�Ӱ��ƽ���ƶ�����֪���������������Һ��c��Ag+����2c��SO42-������C����
D�������ϵĵ�Ϊƽ��㣬����ʱc��Ag+����c��SO42-��������ͼ��a��䵽b��ʱc��Ag+�����䡢c��SO42-�������߲�������D����
��ѡB��
���� ���⿼�����ܵ���ʵ��ܽ�ƽ�⼰ͼ��Ϊ��Ƶ���㣬����Ksp�ļ��㡢ͼ�����ܽ�ƽ���Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ѡ��DΪ�����״��㣬��Ŀ�ѶȲ���


 �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͭ����Ũ�����У�Cu+4H++2NO3?�TCu2++2NO2��+2H2O | |
| B�� | ��FeBr2��Һ��ͨ�����������2Fe2++Cl2�T2Fe3++2Cl? | |
| C�� | ��Al2O3�м��백ˮ��Al2O3+2OH?�T2AlO2?+H2O | |
| D�� | ̼��Ũ������ȣ�C+2H++SO42?�TH2O+SO2��+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1���˶����еĻ��һ����ñ��飨C3H8��Ϊȼ�ϣ�������ֵ�ϸߣ���Ⱦ��С����һ��������ȼ�ϣ��Իش��������⣺
��1���˶����еĻ��һ����ñ��飨C3H8��Ϊȼ�ϣ�������ֵ�ϸߣ���Ⱦ��С����һ��������ȼ�ϣ��Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 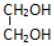 ���Ҵ� ���Ҵ� | B�� | CH3CH��C2H5��CH2CH2CH3 2-�һ����� | ||
| C�� | 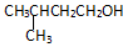 3-��-1-���� 3-��-1-���� | D�� | 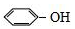 ̼�� ̼�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | Zn��OH��2 | Fe��OH��2 | Fe��OH��3 |
| Ksp | 1��10-17 | 8��10-16 | 4��10-38 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
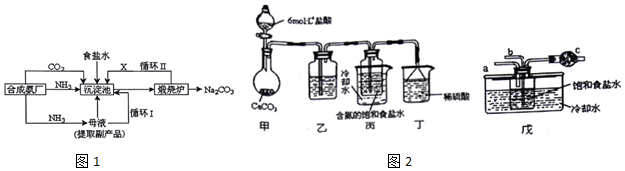
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com