
【题目】(1)在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
CO(g)+H2O(g),其平衡常数K和温度T的关系如下:
T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
①K的表达式为____________________;
②该反应的正反应为__________反应(“吸热”或“放热”);
③下列选项中,能判断该反应已经达到化学平衡状态的是____________(填字母代号)。
A.容器中压强不变 B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl,溶液呈碱性的有__________(填序号);常温下0.01 mol/L HCl溶液的pH=________;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=________。
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
①若向该溶液中滴加NaOH溶液,则先沉淀的是 ____________(填离子符号);
②判断Ksp[Mg(OH)2]____________Ksp[Fe(OH)2](填“>”、“=”或“<”)。
(4)电解装置如图所示:
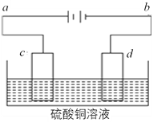
①当用惰性电极电解时,d电极的反应式为____________;
②若用此装置进行铁上镀铜,已知镀层金属采用纯铜且电镀前两电极材料质量相等,电镀一段时间后对电极进行称量发现两极质量差为16 g,则电路中转移的电子为____________mol。
【答案】![]() 放热 BC ②④⑤ 2 1×10-3mol·L-1 Cu2+ > Cu2++2e-=Cu 0.25
放热 BC ②④⑤ 2 1×10-3mol·L-1 Cu2+ > Cu2++2e-=Cu 0.25
【解析】
(1)①由反应方程式可知,反应物为CO2、H2,生成物为CO、H2O,则K=![]() ;
;
②根据表中数据,升高温度,K减小,则升高温度平衡逆向移动,正反应为放热反应;
③A.反应中等号两边气体的计量数之和相等,则气体的物质的量不变,容积恒定,则容器中压强一直不变,所以压强不变不能判断是否达到平衡,A错误;
B.混合气体中CO浓度不变,则v正(CO)=v逆(CO),达到平衡状态,B正确;
C.v正(H2)=v逆(H2O)= v逆(H2),达到平衡状态,C正确;
D.c(CO2)=c(CO),不能确定反应速率的关系,则无法判断是否达到平衡状态,D错误;
答案为BC;
(2)HCl、CH3COOH为酸,水溶液呈酸性;NaOH、NH3·H2O为碱,水溶液呈碱性;CH3COONa为强碱弱酸盐,水溶液呈碱性;NH4Cl为强酸弱碱盐,水溶液呈酸性;常温下0.01 mol/L HCl溶液中c(H+)=0.01 mol/L,溶液的pH=2;pH=11的CH3COONa溶液中c(H+)=10-11 mol/L,则由水电离产生的c(OH-)=1×10-3mol·L-1;
(3)①根据表中数据可知,向溶液中滴加NaOH溶液,先出现沉淀的为Cu2+;
②Ksp=c(M2+)×c2(OH-),溶液中阳离子浓度相同,开始出现沉淀时,pH越小,则c(OH-)越小,Ksp越小,所以Ksp[Mg(OH)2]>Ksp[Fe(OH)2];
(4)①根据电解装置,d为阴极,溶液中的铜离子得电子生成Cu,反应式为Cu2++2e-=Cu;
②用此装置进行铁上镀铜,则铁作阴极,一段时间后对电极进行称量发现两极质量差为16g,则铁电极产生8gCu,电子转移为8g÷64g/mol×2=0.25mol;


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃20mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了40mL,原混合烃中乙炔的体积分数为 ( )
A. 12.5%B. 25%C. 50%D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
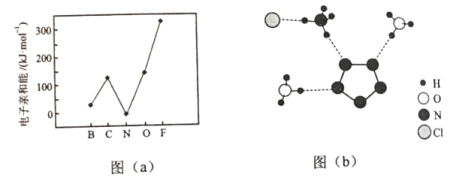
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B. 中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5—中的大π键应表示为____________。
),则N5—中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)NH…Cl、____________、____________。
(4)R的晶体密度为d g·cm3,其立方晶胞参数为a nm,晶胞中含有y个单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制氢技术原理如图所示。容器Ⅰ中发生的某反应a为C(s)+2H2O(g)![]() CO2(g)+2H2(g);ΔH。下列有关说法正确的是( )
CO2(g)+2H2(g);ΔH。下列有关说法正确的是( )
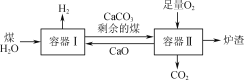
A.已知反应a在一定条件下能够自发进行,则该反应的ΔH<0
B.向容器Ⅰ中加入CaO能有效实现H2与CO2的分离
C.剩余的煤进入容器Ⅱ是为了充分利用其与O2反应放出的热量
D.煤中含有的S在容器Ⅱ中最终转化为CaSO3进入炉渣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是

A. 该有机物分子式为:C7H10O3
B. 该有机物所有质子可能在同—平面
C. 该有机物能发生取代、加成、氧化、还原反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x、y、z……表示)的原子半径相对大小、最高正价或最低负价的变化如下图所示。

请回答下列问题:
(1)f在周期表中的位置为______________;x形成的阴离子的结构示意图为_____________________。
(2)比较d、e常见离子的半径大小:__________________(填化学式,下同);比较g、h的最高价氧化物对应水化物的酸性强弱:_______________________。
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶2∶1 ∶4,其化学式为__________________________。
②能形成共价化合物,写出其中一种的结构简式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是从我国特产植物中提取的一种生物碱,其人工合成路线如图:
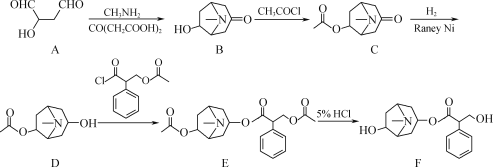
(1)A中含氧官能团的名称为___和___。
(2)C→D的反应类型为___。
(3)E→F的过程中,会有副产物X(分子式为C8H15NO2)生成,写出X的结构简式:___。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:__。
①分子中有醚键;
②能与FeCl3溶液发生显色反应,能与盐酸反应;
③有4种不同化学环境的氢且数目比为9∶2∶2∶2。
(5)已知:R—O—R′+2HBr![]() R—Br+R′—Br十H2O(R、R′表示烃基)。
R—Br+R′—Br十H2O(R、R′表示烃基)。
写出以![]() 、CH3NH2和CO(CH2COOH)2为原料制备
、CH3NH2和CO(CH2COOH)2为原料制备![]() 的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)、如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
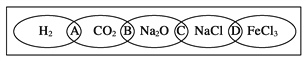
(1)请将分类依据代号填入相应的括号内:
(______)两种物质都不是电解质
(______)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________。
②证明有红褐色胶体生成的实验操作是________________________________________。
(Ⅱ)反应:A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水是氧化剂的是______,水是还原剂的是________。(填序号)
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O,还原剂与氧化剂的物质的量之比:_______,当有0.6mol电子转移时。生成的NO在标准状况的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B.氯气通入到FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++![]() =H2O+BaSO4↓
=H2O+BaSO4↓
D.碳酸氢钠溶液与氢氧化钾反应:HCO3-+OH-=H2O+![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com