
����Ŀ����һ���¶��£���һ�̶��ݻ����ܱ������м��� 1mol A�� 2mol B������������Ӧ��A(g��+2B(g�� ![]() 3C(g��+2D(s�� ��H>0���ﵽƽ��ʱ������1.8 mol C��
3C(g��+2D(s�� ��H>0���ﵽƽ��ʱ������1.8 mol C��
��1������ͬ�����£�����������и�Ϊ����0.3mol A��0.6 mol B��Ҫʹƽ����������C���ʵ����������ԭƽ�����ͬ����D����ʱ����Ӧ���� mol������C��
��2����ά��������������¶Ȳ��䣬��Ӧ���淴Ӧ����ʼ������ͬ�������Ϊ��ʼ���ʣ��ﵽƽ��ʱC��Ϊ1.8 mol ����D����ʼ���ʵ���n(D��Ӧ����������ǣ�n(D��___________��
���ı��¶Ȼ�ѹǿʱ���п��ܸı����ʵľۼ�״̬����ƽ�����Ӱ�����ش���3����4��
��3��������ƽ����ϵ�¶ȣ����ٴδﵽƽ��������ƽ�������»�������ƽ����Է�������δ�����ı䣬�Խ����γ����ֽ���Ŀ���ԭ���ǣ�_________________��
��4������������Ϊ�ݻ��ɱ�����������һ���¶Ⱥͳ�ѹ�£���������ƽ��֮��A�����ʵ���Ũ��Ϊa mol/L���ֳ�������ѹǿ������
����ѹǿΪԭ��1.5��ʱ��A��ƽ��ʱ���ʵ���Ũ��Ϊm mol/L�����m=1.5a��
����ѹǿΪԭ��10��ʱ��A��ƽ��ʱ���ʵ���Ũ��Ϊn mol/L�����n >10 a��
����ѹǿΪԭ��100��ʱ��A��ƽ��ʱ���ʵ���Ũ��Ϊp mol/L�����p<100a��
�Խ����γ����ֽ���Ŀ��ܵ�ԭ��
��1.5��ʱ�� ��
��10��ʱ�� ��
��100��ʱ�� ��
���𰸡�
��1����������2��n(D����0.8mol��
��3�������ߵ�һ���¶��Ժ�D����ת��Ϊ��̬��
��4���������������ߵĻ�ѧ��������ȣ�����ѹǿ���ı�ƽ��״̬����B����ת��Ϊ����̬������ѹǿƽ�������ƶ�����C����ת��Ϊ����̬������ѹǿƽ���ٴ������ƶ���
��������
�����������1���÷�Ӧ������������ʵ�������ķ�Ӧ������ͬ�����£�����������и�Ϊ����0.3mol A��0.6 mol B�����ʵ���֮����ԭ����ͬ�����ڵ�Чƽ�⣬Ҫʹƽ����������C���ʵ����������ԭƽ�����ͬ����D����ʱ�����Լ���������������C���ʴ�Ϊ�����⣻
��2��1mol A�� 2mol Bת��Ϊ������Ϊ3molC��2molD���ﵽƽ��ʱ����1.8 mol C���൱�ڷ�Ӧ��1,2molC��ͬʱ��Ӧ0.8molD�����ά��������������¶Ȳ��䣬��Ӧ���淴Ӧ����ʼ������ͬ�������Ϊ��ʼ���ʣ��ﵽƽ��ʱC��Ϊ1.8 mol����D����ʼ���ʵ�������Ϊ0.8mol���ʴ�Ϊ��n(D����0.8mol��
��3�������ߵ�һ���¶��Ժ�D����ת��Ϊ��̬������ٴδﵽƽ���������ƽ����Է����������䣬�ʴ�Ϊ�������ߵ�һ���¶��Ժ�D����ת��Ϊ��̬��
��4���������������ߵĻ�ѧ��������ȣ�����ѹǿ���ı�ƽ��״̬�����ѹǿΪԭ��1.5��ʱ��A��ƽ��ʱ���ʵ���Ũ��Ϊԭ��1.5�����ʴ�Ϊ�������������ߵĻ�ѧ��������ȣ�����ѹǿ���ı�ƽ��״̬����ѹǿΪԭ��10��ʱ��B����ת��Ϊ����̬������ѹǿƽ�������ƶ���A��ƽ��ʱ���ʵ���Ũ�ȴ���ԭ��10�����ʴ�Ϊ��B����ת��Ϊ����̬������ѹǿƽ�������ƶ�������ѹǿΪԭ��100��ʱ��C����ת��Ϊ����̬������ѹǿƽ���ٴ������ƶ���A��ƽ��ʱ���ʵ���Ũ��С��ԭ��100�����ʴ�Ϊ��C����ת��Ϊ����̬������ѹǿƽ���ٴ������ƶ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ұ��ҵ�У����õ�ⷨ�õ��ơ�þ�����Ƚ�������ԭ����( )
A����������� B�����ǻ��ý���
C���ɱ����� D����Щ�����Ļ������۵�ϵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1��NH4++OH-=NH3��+H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��2����������Һ�в��ܴ������ڣ������������ijǿ���Ե�X ��Һ�п��ܺ��� Fe2+�� A13+�� NH4+�� CO32�D�� SO32�D�� SO42�D�� C1�D�е������֣���ȡ X��Һ��������ʵ�飬ʵ����̼��������£�
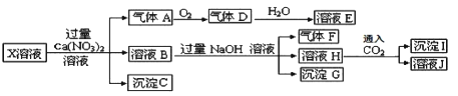
����˵����ȷ����( )
A������A��NO2
B��X�п϶�����Fe2+��A13+��NH4+��SO42�D
C����ҺE������F���ܷ�����ѧ��Ӧ
D��X�в���ȷ����������A13+��C1�D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥNa2CO3����������NaHCO3����ѷ����ǣ� ��
A.������������
B.����NaOH��Һ
C.����
D.�����Һ��ͨ��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����
A. �����к���̼������ʴ�����ȴ����� B. ��������Ƕп����γɺϽ�
C. þ���Ͻ���ʴ�����ܱ��ռ���Һ��ʴ D. �Ͻ��ڳ�ʪ�����и����ױ���ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
���� | ���� | ���������Լ��ͷ��� | |
A | KCl��Һ | I2 | �ƾ�����ȡ����Һ |
B | KNO3 | K2SO4 | Ba(NO3)2��Һ������ |
C | Cu | CuO | ���ᣬ���� |
D | CaCO3 | CaO | H2O������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ˮ��Һ�������ԣ���ԭ��Ϊ (�����ӷ���ʽ��ʾ����0��1 mol��L-1�İ�ˮ�м���������NH4Cl���壬��Һ��PH (��������������������������������������������Һ�е�NH4+��Ũ�� (����������������С������
��2������識��ȷֽ�ɵõ�N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪ ��ƽ�ⳣ������ʽΪ ������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ mol��
��3����N2O��NO��Ӧ����N2��NO2�������仯��ͼ��ʾ��������1molN2����H= kJ��mol-1��
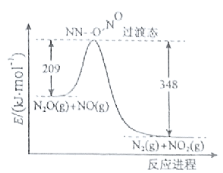
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ܱ������з�����Ӧ��2SO2(g��+O2(g�� ![]() 2SO3(g������Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 mol/L��0.2 mol/L��0.2 mol/L������Ӧ�ﵽ��Ӧ��ʱ���ܵ�������( ��
2SO3(g������Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 mol/L��0.2 mol/L��0.2 mol/L������Ӧ�ﵽ��Ӧ��ʱ���ܵ�������( ��
A��c(SO3��=0.4mol/L
B��c(SO2��=c(SO3��=0.15mol/L
C��c(O2��=0.35mol/L
D��c(SO2��+c(SO3��=0.4mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ������������ȷ����
A��ϡ��pH=3�Ĵ��ᣬ��Һ���������ӵ�Ũ�Ⱦ�����
B��һ��Ũ�ȵ�CH3COOH��NaOH��ϣ���Һ�����ԣ�����Һ��![]()
C��pH��Ϊ11��NaOH��NH3��H2O��Һ�У�ˮ�ĵ���̶Ȳ���ͬ
D���ֱ��к�pH���������ͬ������ʹ��ᣬ���������������Ƶ����ʵ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com