
| A. | 反应后的固体混合物中还含有碳 | |
| B. | 反应后的固体混合物总质量为14.4 g | |
| C. | 反应后的固体混合物中单质Cu的质量为12.8 g | |
| D. | 反应后的固体混合物中氧化物的物质的量为0.05 mol |
分析 反应得到混合气体与通过足量的澄清石灰水,反应一段时间后共收集到1.12L气体(标准状况)为CO的体积,生成沉淀的质量为5.00g为碳酸钙,据此计算CO、二氧化碳的物质的量,反应后的固体混合物含有Cu、Cu2O,可能含有碳,
A.根据碳原子守恒计算参加反应的C的质量,进而确定碳是否完全反应来解答;
B.反应后固体混合物总质量=原固体混合物总质量-生成CO2与CO的总质量;
C.假设CuO完全被还原为Cu,根据Cu守恒计算生成Cu的质量,由产物中CO2、CO中的O原子守恒计算氧化铜失去氧的质量,进而计算CuO反应后的总质量,与Cu的质量比较判断;
D.Cu2O、CuO均含有1个氧原子,根据剩余的氧原子质量计算,剩余氧原子质量=CuO反应后的总质量-Cu元素的质量.
解答 解:由题意可知,生成的n(CO2)=n(CaCO3)=$\frac{5.00g}{100g/mol}$=0.05mol,n(CO)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
A.生成的n(CO2)=n(CaCO3)=$\frac{5.00g}{100g/mol}$=0.05mol,n(CO)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据C守恒可知,参加反应的C的质量=(0.05mol+0.05mol)×12g/mol=1.2g,故还有2g-1.2g=0.8g碳未参与反应,故A正确;
B.反应后固体总质量=16g+2g-0.05mol×(44g/mol+28g/mol)=14.4g,故B正确;
C.假设CuO完全被还原为Cu,根据Cu守恒生成Cu的质量=$\frac{16g}{80g/mol}$×64g/mol=12.8g,由产物中CO2、CO中的O原子守恒可知失去氧的质量=(0.05mol×2+0.05mol)×16g/mol=2.4g,故CuO反应后的总质量=16g-2.4g=13.6g,故反应后固体中Cu的质量小于12.8g,故C错误;
D.反应后m(O)=13.6g-12.8g=0.8g,Cu2O、CuO均含有1个氧原子,根据氧原子守恒可知反应后的固体混合物中氧化物的物质的量=$\frac{0.8g}{16g/mol}$=0.05 mol,故D正确,
故选C.
点评 本题考查混合物计算,为高频考点,侧重对解题方法技巧与思维能力的考查,注意利用守恒思想进行解答,难度较大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
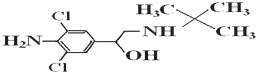
| A. | 摩尔质量为313.5g | |
| B. | 属于芳香烃类化合物 | |
| C. | 瘦肉精的分子式为C12H17Cl2N2O | |
| D. | 可发生加成反应、取代反应、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm=10-6m) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| C. | AlCl3溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O | |
| D. | 向NaHCO3溶液中加入过量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 小苏打是一种膨松剂,可用于制作馒头和面包 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对太阳光进行光谱分析,可证明太阳上是否含有Ar元素 | |
| B. | 利用焰色反应鉴别NaCl和KCl两种溶液 | |
| C. | 利用石灰水鉴别纯碱和小苏打两种溶液 | |
| D. | 利用烧碱溶液鉴别MgCl2和AlCl3两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
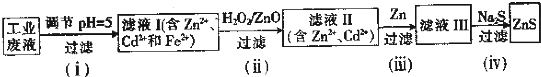
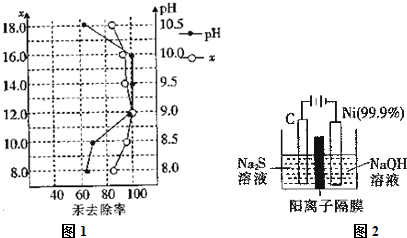
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com