
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co的价电子排布式为__,的I4(Co)__的I4(Fe)(填>、<或者=),原因是__。
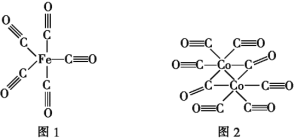
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中0.1molFe(CO)5含有配位键__个,写出2个与CO互为等电子体微粒__,图2中的σ键和π键个数之比是__(填元素符号)。
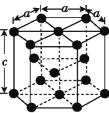
(3)金属钴的堆积方式为六方最密堆积,其配位数是__;该晶胞的边长为xnm,高为ynm,该晶胞的密度为__g·cm-3。(NA表示阿伏加德罗常数的值,列出代数式)
【答案】3d74s2 < Co失去三个电子后会变成[Ar]3d6,更容易再失去一个电子形成半满状态[Ar]3d5,Fe失去三个电子后会变成[Ar]3d5,达到半充满的稳定状态,更难再失去一个电子 6.02×1023(或NA) N2、CN- 19:14 12 ![]()
【解析】
(1)Co的原子序数为27,价电子排布式为3d74s2;Fe失去3个电子变为3d5,为半满稳定;
(2)Fe(CO)5中C原子和Fe原子之间形成配位键,-C≡O中C原子和O原子之间形成1个配位键;等电子体是原子个数和电子数均相等的粒子;一个单键含有1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键;
(3)六方最密堆积,配位数是12;钻晶体晶胞中顶点占![]() ,面心占
,面心占![]() ,体内占1,据此计算晶胞中原子个数;计算结构单元中原子总质量,利用
,体内占1,据此计算晶胞中原子个数;计算结构单元中原子总质量,利用![]() 进行计算;
进行计算;
(1)Co的原子序数为27,则Co核外电子排布式为:1s22s22p63s23p63d74s2,价电子排布式为:3d74s2;第四电离能I4(Co)<I4(Fe),其原因是铁失去的是较稳定的3d5的一个电子,钴失去的是3d6上的一个电子,易失去;故答案为:3d74s2;<;Co失去三个电子后会变成[Ar]3d6,更容易再失去一个电子形成半满状态[Ar]3d5,Fe失去三个电子后会变成[Ar]3d5,达到半充满的稳定状态,更难再失去一个电子;
(2)Fe(CO)5中C原子和Fe原子之间形成配位键,-C≡O中C原子和O原子之间形成1个配位键,所以0.1 mol Fe(CO)5含有1mol配位键,个数为6.02×1023(或NA);等电子体是原子个数和电子数均相等的粒子,CO含2个原子核14个电子,其等电子体可以是:N2、CN-;一个单键含有1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键,则图2中的σ键和π键个数之比是19:14
故答案为:6.02×1023(或NA);N2、CN-;19:14;
(3)六方最密堆积,配位数是12;钻晶体晶胞中顶点占![]() ,面心占
,面心占![]() ,体内占1,则该晶胞中原子个数为
,体内占1,则该晶胞中原子个数为![]() ,图中结构单元底面为正六边形,边长为x nm,底面面积为
,图中结构单元底面为正六边形,边长为x nm,底面面积为![]() ,结构单元的体积为
,结构单元的体积为![]() ,结构单元中原子总质量为
,结构单元中原子总质量为![]() ,则晶体密度
,则晶体密度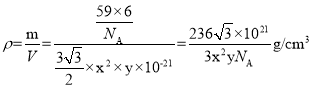 ,故答案为:12;
,故答案为:12;![]() 。
。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】H·C·Brown和Schlesinger于1942年在芝加哥大学发现的硼氢化钠(NaBH4)是最常用的还原剂之一,反应常生成偏硼酸钠(NaBO2)。有关实验流程如图所示:
![]()
I.氢化钠的制备:
已知NaH能在潮湿的空气中自燃。甲同学用如图所示装置(每种装置只选一次)来制取NaH。
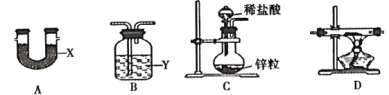
(1)装置的连接顺序是C→____________→D→__________,X、Y分别是__________、__________。
(2)通入H2,点燃装置D处酒精灯之前的实验操作是__________。若省略该操作,可能导致的后果是__________。
Ⅱ.硼氢化钠的制备及纯度测定:
将硼硅酸钠与氢化钠在450~500℃温度和(3.04~5.07)×105Pa压力下反应,生成硼氢化钠和硅酸钠。
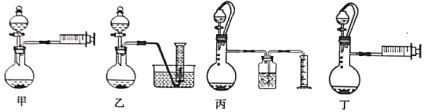
(3)乙同学欲通过测定硼氢化钠与稀硫酸反应生成氢气的体积来确定硼氢化钠样品的纯度(杂质只有氢化钠),设计了以下4种装置,从易操作性、准确性角度考虑,宜选装置。__________
(4)称取4.04g样品(杂质只有氢化钠),重复实验操作三次,测得生成气体的平均体积为9.184L(已折算为标准状况),则样品中硼氢化钠的纯度为__________%(结果保留两位有效数字)。
Ⅲ.碉氢化钠的性质检验:
(5)碱性条件下,丙同学将NaBH4与CuSO4溶液反应可得到纳米铜和NaBO2,其离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究 Na、Mg、Al的金属性强弱顺序,某课外小组同学进行了如下实验:
实验 步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中; 2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3将一小段镁带投入稀盐酸中; 4将一小片铝投入稀盐酸中. |
实验 现象 | ①剧烈反应,迅速生成大量的气体 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 ③反应不剧烈,产生无色气体 ④有气体产生,溶液变成红色 |
(1)请在下表中填写与实验步骤对应的实验现象序号:
实验步骤 | 1 | 2 | 3 | 4 |
实验现象 | _____ | _____ | _____ | _____ |
(2)请写出镁与水反应的化学方程式:_______________。
(3)实验结论是___________________。
(4)请你补充该小组同学用原子结构理论对上述实验结论的解释:
同周期元素从左至右原子的电子层数相同,随着核电荷数逐渐增多,原子半径逐渐_______,失电子能力逐渐_______,因此________逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①写出基态Mn原子的价电子排布式为___________________________。在元素周期表中,该元素在________(填“s”“p”“d”“f”或“ds”)区。与Mn同周期的所有过渡元素的基态原子中,最外层电子数与Mn不同的元素有__________种。
②CO32-的空间构型是__________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为___________________________________。
②CO2分子中C原子轨道的杂化类型为________________________________________。
③1 mol甲醛(HCHO)分子中含有的σ键数目为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,已知A元素原子的第一层和第三层电子数相同;B元素原子的第二层比第一层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数;D元素的原子核外有4个电子层,第一层与第二层电子数之和等于第三层与第四层电子数之和。根据题意,完成下列填空:
(1)元素符号:A__,B__,C__,D___。
(2)A的原子结构示意图__,B的阴离子结构示意图___,C的阳离子结构示意图__,D的原子结构示意图__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤素(F、Cl、Br、I)叙述正确的是( )
A.其单质在常压下的沸点,随着卤素核电荷数的增多逐渐降低
B.单质和水反应通式:X2+H2O=HX+HXO(用X表示卤素),剧烈程度随着核电荷数的增多而减弱
C.单质和氢气反应的通式:X2+H2=2HX(条件不同),剧烈程度随着卤素核电荷数的增多而减弱
D.随着卤素核电荷数的增多,单质的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
B.常温常压下,18g H2O含有的原子总数为3NA
C.标准状况下,11.2LCH3CH2OH中含有分子的数目为0.5NA
D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com