
(13分)某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验
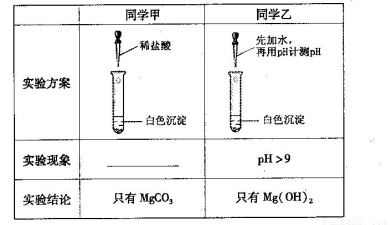
(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。
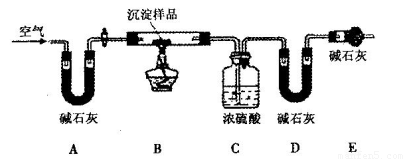
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
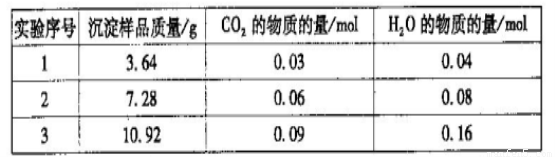
三次实验所得数据如下:(部分数据已换算为相应的物质的量)
 ??
??
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O?????? b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O??? d.Mg5(OH)4(CO3)3·2H2O
(1)沉淀溶解,有气泡产生(2分)
(2)取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀。(2分,或取最后一次洗涤液,用焰色反应检验存在的钠离子。答案合理即可得分)? (3)>(2分)
(4)先通入一会儿空气,再加热(2分)? (5)防止空气中的水蒸气和CO2进入装置D(2分)
(6)3(1分) c(2分)
【解析】
试题分析:(1)碳酸镁与稀盐酸反应生成氯化镁、水和CO2,因此实验现象是沉淀溶解,有气泡产生。
(2)由于沉淀表面有吸附的氯离子,所以可以通过检验氯离子来判断沉淀是否洗涤干净,即取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀即证明没有洗涤干净。
(3)由于氢氧化镁的溶度积常数小于碳酸镁的溶度积常数,所以Ksp(MgCO3)>Ksp [Mg(OH)2]。
(4)由于装置中有残留的空气,而空气中通过碱石灰时水蒸气和CO2被吸收,所以因此先通入一会儿空气,再加热。
(5)由于空气中还含有水蒸气和CO2会进入装置D干扰实验,所以E装置中碱石灰的作用是防止空气中的水蒸气和CO2进入装置D。
(6)由于水蒸气和CO2的物质的量与样品的质量成比例,因此根据实验1、2中的数据可知,实验3中水蒸气的物质的量偏大(应该是0.12mol),应该舍去。根据表中数据可知CO2与水蒸气的物质的量之比是3:4,则a.Mg2(OH)2CO3·3H2O中CO2与水蒸气的物质的量之比是1:4,a不正确; b.Mg(OH)2(CO3)2·3H2O中CO2与水蒸气的物质的量之比是1:2,b不正确;c.Mg4(OH)2(CO3)3·3H2O中CO2与水蒸气的物质的量之比是3:4,c正确;d.Mg5(OH)4(CO3)3·2H2O中CO2与水蒸气的物质的量之比是3:4,但3.64g该物质得不到0.03molCO2,d不正确,答案选c。
考点:考查实验方案设计与评价、物质检验、实验数据处理


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源:2012-2013学年浙江省高三上学期期中考试化学试卷(解析版) 题型:实验题
(13分) 某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在”。为此,他们设计了如下图所示的装置。回答下列问题:

(1)写出A中Cu与HNO3反应可能的离子方程式 。
(2)实验前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3 既无挥发也无分解,则:①参加反应的HNO3的物质的量为 mol
②若已测出反应后E装置的生成物中含氮元素的质量m克,则为确定合金中Cu的质量分数还需测定的数据是 ,若测得该数据为n,写出合金中铜的质量(设为x克)的求算式子(只需列式子,不需解方程) 。
(5)为减小上述实验误差,在D中观察到实验现象后还须进行的操作是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。只利用A装置中反应后的溶液进行简单的操作,也可以确定合金中Cu的质量分数,其实验操作过程为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com