
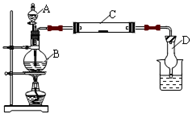
 为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答: Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O, Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:江西省南昌一中2012届高三11月月考化学试题(人教版) 题型:058
Ⅰ.化学反应经常伴随着颜色变化,下列有关反应显示的颜色正确的有
①氢氧化亚铁在空气中最终变为灰绿色;
②淀粉溶液遇碘化钾变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色
④品红溶液通入过量氯气后褪色
⑤无水硫酸铜吸收水蒸气变成浅绿色;
⑥新制氯水久置后变为无色;
Ⅱ.某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置.
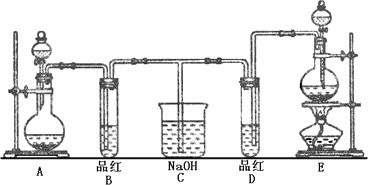
(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中________装置(填装置序号)制Cl2.在制Cl2的反应中MnO2表现出的性质是________.
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:________,D:________.
(3)装置C的作用是________.
(4)甲乙两同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性.试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:________.
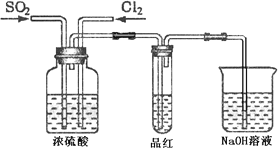
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:________,并写出其相应的离子方程式:________.
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是:________.
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题
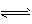 H+ +ClO-,为了探究HClO的漂白性,某化学兴趣小组从A、B、C、D中选用仪器制备干燥、纯净的氯气,并设计了如下实验。
H+ +ClO-,为了探究HClO的漂白性,某化学兴趣小组从A、B、C、D中选用仪器制备干燥、纯净的氯气,并设计了如下实验。 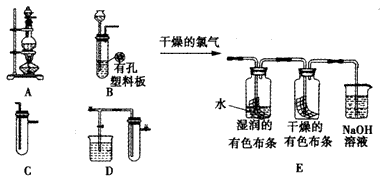

查看答案和解析>>
科目:高中化学 来源:2012届江西省南昌一中高三11月月考化学试卷 题型:实验题
(12分)
Ⅰ.(3分)化学反应经常伴随着颜色变化,下列有关反应显示的颜色正确的有
①氢氧化亚铁在空气中最终变为灰绿色; ②淀粉溶液遇碘化钾变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色 ④品红溶液通入过量氯气后褪色
⑤无水硫酸铜吸收水蒸气变成浅绿色; ⑥新制氯水久置后变为无色;
Ⅱ.(9分)某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
(1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 装置(填装置序号)制Cl2。在制Cl2的反应中MnO2表现出的性质是 。
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B: ,D: 。
(3) 装置C的作用是 。
(4) 甲乙两同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: 。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ,并写出其相应的离子方程式: 。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com