
已知常温下,浓度均为0.1mol•L﹣1的4种钠盐溶液pH如下表:下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 8.3 | 5.2 |
|
| A. | 足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO﹣=HClO+HSO3﹣ |
|
| B. | 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
|
| C. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
|
| D. | NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3﹣)>c(SO32﹣)>c(OH﹣) |
| 离子浓度大小的比较;盐类水解的应用. | |
| 分析: | 根据相同浓度的钠盐溶液pH大小知,酸根离子水解程度大小顺序是:CO32﹣>ClO﹣>HCO3﹣>HSO3﹣,则酸的强弱顺序是H2SO3>H2CO3>HClO>HCO3﹣, A.次氯酸不会置换出亚硫酸氢根离子,且次氯酸根离子能够将二氧化硫氧化成磷酸根离子; B.盐酸和碳酸氢钠反应生成氯化钠和二氧化碳,促进氯气和水反应; C.酸根离子水解程度越大,则酸的酸性越弱; D.亚硫酸氢钠溶液呈酸性,说明HSO3﹣电离程度大于水解程度,无论电离还是水解其程度都较小. |
| 解答: | 解:根据表中盐的pH,可以确定弱离子的水解程度:CO32﹣>ClO﹣>HCO3﹣>HSO3﹣,所以酸性顺序是:HCO3﹣<HClO<H2CO3<H2SO3, A.酸性顺序是:HCO3﹣<HClO<H2CO3<H2SO3,弱酸制不出强酸,即H2O+SO2+ClO﹣=HClO+HSO3﹣不会发生,且次氯酸能将亚硫酸氢根离子氧化,故A错误; B.盐酸和碳酸氢钠反应生成氯化钠和二氧化碳,促进氯气和水反应,次氯酸和碳酸氢钠不反应,所以导致溶液中次氯酸浓度增大,故B正确; C.酸根离子水解程度越大,则酸的酸性越弱,酸根离子水解程度大小顺序是:CO32﹣>ClO﹣>HCO3﹣>HSO3﹣,则酸的强弱顺序是H2SO3>H2CO3>HClO>HCO3﹣,所以常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是HClO溶液,故C错误; D.亚硫酸氢钠溶液呈酸性,说明HSO3﹣电离程度大于水解程度,无论电离还是水解的程度都较小,所以c(H+)<c(HSO3﹣),正确的离子浓度大小顺序为:c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣),故D错误; 故选B. |
| 点评: | 本题考查离子浓度大小比较、盐的水解原理,题目难度中等,根据钠盐溶液pH大小确定相对应酸的强弱,再结合强酸制取弱酸、酸式酸根离子电离和水解程度相对大小等知识点来分析解答. |


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和 H2O的总质量为27.6g,其中H2O的质量为10.8g,则CO的质量是( )
|
| A. | 1.4 g | B. | 2.2 g |
|
| C. | 4.4 g | D. | 在2.2 g和4.4 g之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
瓦斯分析仪(如图甲)工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。
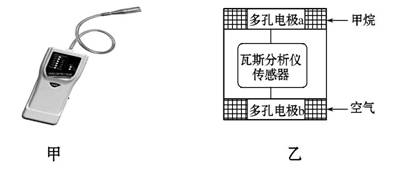
下列有关叙述中正确的是 ( )
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+4O2-―8e-====CO2+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
有关甲烷和乙烷的说法中,错误的是( )
|
| A. | 互为同系物 |
|
| B. | 均不能使高锰酸钾酸性溶液褪色 |
|
| C. | 在核磁共振氢谱图(1H核磁共振谱图)中,均只有1个吸收峰 |
|
| D. | 二氯取代物均为两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献.
①氟化氢(HF)的水溶液能雕刻玻璃.制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式).
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原滴定实验与中和滴定原理相似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液,或反之).现用0.1mol•L﹣1酸性KMnO4溶液(标准液)滴定未知浓度的H2O2水溶液(待测液),反应离子方程式是:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O,请回答下列问题:
(1)该滴定实验一定不需要用到的仪器有下列中的 (填字母).
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、白纸 D、锥形瓶E、铁架台 F、滴定管夹 G、量筒(10mL)
(2)滴定时是否需要添加指示剂 ,理由 .
(3)实验中取H2O2溶液V mL,滴定前后滴定管液面刻度分别为a mL和b mL,则H2O2浓度为 .
(4)在滴定过程中,下列操作会使过氧化氢溶液测定浓度比实际浓度偏高的是 .
①盛装标准液的滴定管用蒸馏水洗净后未用标准液润洗
②锥形瓶中有少量蒸馏水,实验时没有烘干处理
③读数时,滴定前平视,滴定后俯视.
④滴定前盛装标准液的滴定管尖端气泡未排除,滴定后气泡消失
A.②③B.①④C.①③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )
| 物质及其杂质 | 检验 | 除杂 | |
| A | Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B | NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件相同)。则下列有关说法正确的是( )
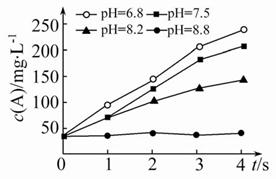
A.若增大压强,该反应的反应速率一定增大
B.pH=6.8时,随着反应的进行反应速率逐渐增大
C.一定pH范围内,溶液中H+浓度越小,反应速率越快
D.可采用调节pH的方法使反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
下列应用不涉及氧化还原反应的是
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com