
【题目】将等物质的量钠、过氧化钠、氧化钠、氢氧化钠加入到足量且等量的水中,形成溶液质量分数分别为X、Y、Z、W,下列关系正确的是
A. X<W<Y<Z B. W<X<Y<Z C. W<X<Y=Z D. W<X<Y<Z
【答案】C
【解析】
试题分析:钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+1/2H2↑,溶液增加的质量=m(Na)-m(H2);
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O);
Na2O2+H2O=2NaOH+1/2O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O);
将氢氧化钠加入水中,溶液增加的质量为氢氧化钠的质量;
假设都为0.1mol,水的质量为mg,则0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于水所得溶液的质量分数分别为:![]() ×100%、
×100%、![]() ×100%、
×100%、![]() ×100%、
×100%、![]() ×100%,所以则四个烧杯内所得溶液的质量分数的大小顺序正确的是Y=Z>X>W,答案选C。
×100%,所以则四个烧杯内所得溶液的质量分数的大小顺序正确的是Y=Z>X>W,答案选C。


科目:高中化学 来源: 题型:
【题目】在蒸发皿中加热蒸干并灼烧(<400℃)下列物质的溶液,可以得到该物质的固体的是
A.AlCl3 B.NaHCO3 C.MgSO4 D.Ca(HCO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物有许多重要的用途
(1)碳酸钠可用于从海水提取溴,涉及的反应如:
3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3
在上述反应中用双线桥标出电字转移的方向和数目,该反应中氧化剂与还原剂的物质的量之比是_____________。
(2)少量的钠应保存在_______中;钠着火时应采取的灭火措施是:__________。
(3)过氧化钠作潜艇供氧剂时发生的化学反应方程式是_____________。
(4)加热Al片的实验现象是_________________,原因是_____________。
(5)检验KCl中阳离子的方法及现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯被国际上公认为安全、无毒的绿色消毒剂,以KClO3溶液为原料,采用电解法生产二氧化氯反应原理如下:4ClO3-+2H2O ![]() 4ClO2↑+ O2↑+4OH-。下列说法正确的是
4ClO2↑+ O2↑+4OH-。下列说法正确的是
A.电解过程中OH-向阴极迁移
B.阳极反应式为:4OH- -4e-= O2↑+2H2O
C.毎有l mol电子转移,生成标准状况下5.6L气体
D.无法判断电解过程中阴极区溶液的pH变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.用热的纯碱溶液去油污效果更好
C.制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法
D.室温下,向0.1mol/L的HF溶液中加入少量水溶液显碱性的物质,HF的电离程度一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g)+O2(g)2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 分子式为C7H8O含有苯环且属于醇类的同分异构体有4种
B. 乙炔能使溴的四氯化碳溶液褪色是发生了氧化反应
C. 苯分子中所有原子都在同一平面上
D. 乙酸乙酯少量乙酸杂质可加饱和NaOH溶液后经分液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是分析化学中常用实验方法,请根据滴定法的有关知识回答下列问题:
Ⅰ、某学生用0.1 mol·L-1 的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上1~2cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_________AF。
(2)上述B步骤操作的目的是______________。
(3)在进行C步操作滴定前排气泡时,应选择下图2中的__________(填序号),若用25mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)__________(①=10mL,②=15mL,③<10mL,④>15mL)。

(4)判断以下操作,对测定结果盐酸浓度的影响(填“偏高”、“偏低”或““无影响”)
①上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_________。
②若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___________。
③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将____________。
Ⅱ、氧化还原滴定法实际生产中运用较为广泛的方法。制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2·xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2。
可用氧化还原滴定法测定TiO2的质量分数。在一定条件下,将粉体溶解并将溶液中的Ti2-氧化为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。【注:NH4Fe(SO4)2是一种复盐,含有两种阳离子】。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量稀H2SO4的原因是____________________,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需用到图中的______________(填序号)
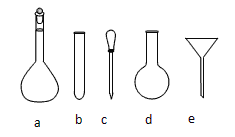
检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
(3)滴定终点的现象是:当滴入最后一滴NH4Fe(SO4)2标准溶液时_______________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)粉体试样wg,消耗v ml c mol·L-1 NH4Fe(SO4)2标准溶液。则TiO2质量分数表达式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com